
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为2mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加3.4g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为5.6g
B.参加反应的硝酸的物质的量为0.2mol
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.标况下产物NO体积为4.48L
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
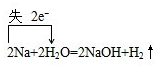 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
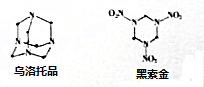
| A. | 2:3 | B. | 1:3 | C. | 1:4 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3

查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA
B.46gNO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,22.4LSO3中含有的分子数为NA.
D.1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列实验可实现检验或鉴别目的的是
A.根据反应MnO4-+5Fe2++8H+=Mn2-+5Fe3++4H2O可知,用酸性KMnO4溶液可检验FeSO4.7H2O是否变质
B.用CO2鉴别NaAlO2溶液和CH3COONa溶液
C.用湿润的碘化钾淀粉试剂鉴别Br2(g)和NO2
D.用KOH溶液鉴别SO3(g)和SO2
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列实验中,对于杂质(括号中的物质为杂质)的检验和除杂方法均正确的是
选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
B | NaCl(NH4Cl) | 加热 | 加热 |
C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期期中化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列说法中正确的是
①常温下,0.1molCl2与足量NaOH溶液反应, 转移的电子数目为0.2NA
转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
⑦1.0L 1.0 mol·L-1 Na2SiO3水溶液中含有的氧原子数为3NA
A.①⑤⑦ B.③④⑥
C.②④⑤ D.②③⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com