
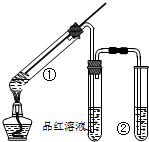
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
分析 A.根据浓硫酸中元素的化合价是否变化判断;
B.品红溶液是检验二氧化硫的存在,不能用于吸收二氧化硫;
C.通过移动可移动的铜丝,可以控制反应的开始与停止,该实验体现环境保护和节约化学试剂的理念;
D.氢氧化钠溶液能够吸收二氧化硫.
解答 解:A.浓硫酸和铜反应生成硫酸铜、二氧化硫和水,所以部分硫酸有化合价的变化,部分硫酸化合价不变,所以浓硫酸既表现了强氧化性,又表现了酸性,故A正确;
B.SO2具有漂白性,可用品红溶液验证SO2的生成,但是不能用品红溶液吸收二氧化硫,故B错误;
C.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触则反应停止,可通过上下移动①中铜丝可控制SO2的量,既能够保护环境,也能够节约试剂,故C正确;
D.SO2为酸性气体,具有污染性,可与碱发生反应,可用NaOH溶液吸收多余的SO2,故D正确;
故选B.
点评 本题考查了化学实验装置及应用,题目难度中等,注意掌握化学实验基本操作方法,明确常见物质的性质及检验方法,明确实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
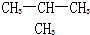 D.甲烷和庚烷
D.甲烷和庚烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、K+、NO3-、SO42- | ||
| C. | Fe2+、K+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、NaCl、CO2 | B. | HF、HCl、HBr | C. | NaCl、KCl、RbCl | D. | Na、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在晶体中只要有阴离子就一定有阳离子 | |
| B. | 1mol SiO2晶体中含2mol Si-O键 | |
| C. | 干冰晶体中每个CO2分子周围紧邻12个CO2分子 | |
| D. | 金刚石晶体中的最小环由6个碳原子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24.1% | B. | 25.9% | C. | 40.3% | D. | 48.1% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com