
分析 (1)根据燃烧热的概念:1mol可燃物充分燃烧生成稳定氧化物放出的热量,结合选项判断;
(2)利用盖斯定律及已知热化学方程式写出目标反应的热化学方程式;物质的能量越低,越稳定,据此判断白磷和红磷的稳定性.
解答 解:(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8kJ•mol-1,
A.H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ•mol-1水应为液态水,故错误;
B.2H2(g)+O2(g)=2H2O(l)△H=-517.6kJ•mol-1故正确;
C.H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1-水为液态水,故错误;
D.2H2(g)+O2(g)=2H2O(l)△H=+517.6J•mol-1反应为放热,故错误;
故答案为:B;
(2)已知:①P4(s,白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ•mol-1
②P(s,红磷)+$\frac{5}{4}$O2 (g)=$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1-
则据盖斯定律,①-②×4可得:P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1,
从上面的热化学方程式可知,白磷转化为红磷是放热反应,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定,
故答案为:P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1;红磷;低.
点评 本题考查了燃烧热、盖斯定律在热化学方程式计算中的应用,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律的含义及在热化学方程式计算中的应用方法.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.2mol/(L•s) | B. | v(SO3)=8mol/(L•min) | C. | v(SO2)=6mol/(L•min) | D. | v(O2)=6mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
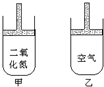 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
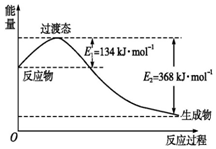 写出下列反应的热化学方程式
写出下列反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为0 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com