
【题目】2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图所示。已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH1=-99 kJ/mol。请回答下列问题:

(1)图中A、C分别表示_____、____,E的大小对该反应的反应热有无影响?____(填“有”或“无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____,理由是_________。
(2)图中ΔH=____kJ/mol。
(3)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=____ mol·L-1·min-1,v(SO3)=___mol·L-1·min-1。
【答案】反应物能量 生成物能量 无影响 降低 催化剂改变反应历程,降低活化能E -198 0.025 0.05
【解析】
(1)反应物总能量大于生成物总能量,为放热反应,加入催化剂,活化能减小,反应反应热不变;
(2)根据反应2SO2(g)+O2(g)2SO3(g)结合1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1计算反应热;
(3)依据化学反应速率之比等于系数之比计算得到。
(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应热不变;该反应通常用V2O5作催化剂,催化剂改变反应速率,降低反应的活化能,改变反应历程,但不改变化学平衡,所以加V2O5会使图中B点降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)2SO3(g)△H=-198kJmol-1;
(3)反应的化学方程式为:2SO2(g)+O2(g)2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05molL-1min-1,依据比例计算得到v(O2)=0.025mol/Lmin;v(SO3)=0.05molL-1min-1。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )

A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A.38g3H2O2中含有3NA共价键
B.标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C.常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.1L 0.5mol·L1 pH=7的CH3COONH4溶液中NH4+数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
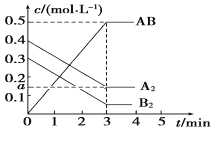
A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.8.4g乙烯和丙烯混合气体中含C-H键个数为1.2NA个
B.盛有NO2的密闭容器在含有NA个氧原子,则NO2的物质的量是0.5mol
C.标准状况下,22.4L二氯甲烷的分子数为NA个
D.电解精炼铜时,若阳极质量减少64g,则阴极得电子数为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
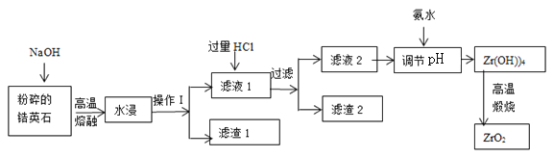
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )

A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4![]() FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
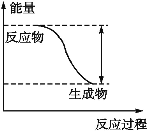
(1)该反应为____________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____________(填字母)。
A.改铁片为铁粉B.改稀硫酸为98%的浓硫酸C.升高温度D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____________(填“正”或“负”)极。铜片上产生的现象为____________,该极上发生的电极反应为____________,铁电极的电极反应为____________,外电路中电子由____________(填“正”或“负”,下同)极向____________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示合成路线判断下列说法错误的是( )
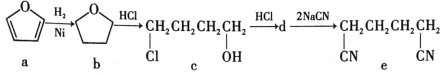
A.a→b的反应属于加成反应B.d的结构简式为ClCH2(CH2)2CH2C1
C.c→d的反应属于消去反应D.d→e的反应属于取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com