
【题目】在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A. 电离能最小的电子能量最高
B. 在离核最近区域内运动的电子能量最低
C. 最易失去的电子能量最高
D. p轨道电子能量一定高于s轨道电子能量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(本题满分18分)二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 45 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
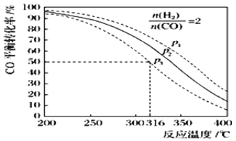
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
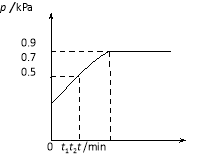
A.从反应开始到t1时的平均反应速率
v(X)=![]() mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面哪一实例证明微量元素是维持正常生命活动不可缺少的
A. 缺Mg时叶片变黄 B. 油菜缺B时只开花不结果
C. 动物血液钙盐含量太低会抽搐 D. 缺P会影响核酸的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同是( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子排布式中,原子处于激发状态的是( )
A. 1s22s22p5 B. 1s22s22p43s2
C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d34s2
查看答案和解析>>
科目:高中化学 来源: 题型:
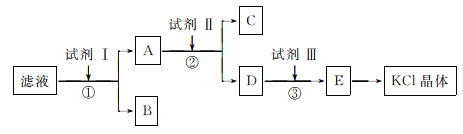
【题目】KC1样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KC1,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
回答下列问题:
(1)为检验起始滤液中的Cl-,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂I的化学式为________________,判断试剂I已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KC1晶体质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
请回答下列问题:
(1)上述仪器中,在配制稀盐酸时需要使用的有______________________(填序号),还缺少的仪器是______________(填仪器名称)。
(2)计算:所需浓盐酸的物质的量浓度为___________,量取浓盐酸的体积为_________mL。量取浓盐酸时应选用量筒的规格为___________。
①10 mL ②50 mL ③100 mL
(3)将所配制的稀盐酸进行测定,发现浓度大于0.8mol/L。请你分析配制过程中可能引起浓度偏高的原因(答出两点) 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com