

分析 以绿矾(FeSO4•7H2O)制备高铁酸钾,由制备流程可知,绿矾溶于水形成FeSO4溶液,加入稀硫酸和过氧化氢,亚铁离子与过氧化氢发生氧化还原反应生成铁离子,向硫酸铁溶液加入NaClO和NaOH混合溶液发生反应:3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O,部分铁离子生成Fe(OH)3,过滤分离出Fe(OH)3,再加饱和KOH发生Na2FeO4+2KOH=K2FeO4+2NaOH,经过冷却结晶,过滤洗涤、干燥几个步骤,洗涤选择乙醇,防止高铁酸钾溶解而损失,以此来解答.
解答 解:(1)氧化过程亚铁离子与过氧化氢发生氧化还原反应生成铁离子,反应为:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)“合成”时生成Na2FeO4的离子方程式为:3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O;
根据图2:K2FeO4的稳定性随着温度的升高而减弱,pH越小,氢离子浓度增大,FeO42-稳定性越弱,
A.充分搅拌反应液,正确;
B.60℃左右时,FeO42-稳定性弱,错误;
C.将氧化后所得溶液分多次加入NaClO和NaOH混合溶液中,碱性较强,FeO42-稳定性强,正确;
D.将NaClO和NaOH混合溶液分多次加入氧化后所得溶液中,碱性较弱,FeO42-稳定性弱,错误;
故答案为:3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O;AC;
(3)硫酸铁溶液中加入NaClO和NaOH混合溶液,部分铁离子生成Fe(OH)3,过滤分离出Fe(OH)3,滤渣为Fe(OH)3,
故答案为:Fe(OH)3;
(4)加饱和KOH发生Na2FeO4+2KOH=K2FeO4+2NaOH,由溶解度小的制取溶解度更小的,故该温度下两者饱和溶液的物质的量浓度c(K2FeO4)<c(Na2FeO4);母液中的阴离子除FeO42-和OH-外,一定还含有SO42-、Cl-;
故答案为:<;SO42-、Cl-.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | a-c=m-n | B. | b+d=m+n | ||
| C. | 元素的金属性:X>Y>Z>R | D. | 离子半径:Z>R>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 3.36L | C. | 4.48L | D. | 6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3 CH2C (CH3)3 2,2-二甲基丁烷 | B. | (C2H5)2CHCH3 2-乙基丁烷 | ||
| C. | (CH3)2CHCH(CH3)2 2,3-二甲基丁烷 | D. | CH3(CH2)4CH3 己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
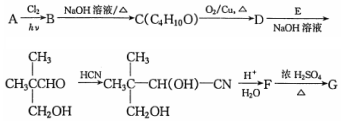
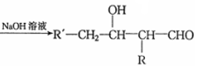
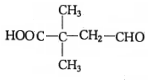
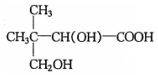 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$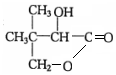 +H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为
+H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为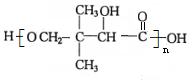 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电影时,放映室射到银幕上的光柱 | |
| B. | 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| C. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 加电解质可使某种胶体聚沉,这是中和胶体粒子所带电荷的缘故 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com