
| A. | 1L 1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 体积为6L 的 O2,其质量不可能为8 g | |
| C. | 1 mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子 | |
| D. | 1mol 过氧化钠中阴离子所带电荷数为2NA |
分析 A.氯化氢为强电解质,在溶液中完全电离,不存在氯化氢分子;
B.温度和压强影响气体摩尔体积,所以一定条件下气体摩尔体积可能为24mol/L,6L氧气的物质的量为0.25mol,质量为8g;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.过氧化钠中阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子.
解答 解:A.HCl在溶液中完全电离,溶液中不存在氯化氢分子,故A错误;
B.适当改变温度和压强,气体摩尔体积可以为24L/mol,则该条件下6L氧气的物质的量为:$\frac{6L}{24L/mol}$=0.25mol,质量为:32g/mol×0.25mol=8g,故B错误;
C.由于Fe(OH)3胶粒为氢氧化铁的聚集体,则无法计算该胶体中含有胶粒数目,故C错误;
D.1mol 过氧化钠中含有1mol过氧根离子,阴离子所带电荷的物质的量为2mol,电荷数为2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:多选题
| A. | 有丁达尔现象 | B. | 浑浊不透明 | ||
| C. | 能透过滤纸 | D. | 所得分散系不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按分散系中分散质粒子的大小可以把分散系分为溶液、胶体和浊液 | |
| B. | 氧化还原反应的本质是化合价的升降 | |
| C. | 金属的硬度都比较大,不能用刀切 | |
| D. | 氯气常用做自来水的净水剂,原因是氯气无毒,对人体无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:Na+、Fe3+、NO3-、Cl- | |
| B. | pH=11的透明溶液中:Na+、K+、MnO4-、CO32- | |
| C. | 在含有HCO3-的溶液中:H+、K+、SO42-、Cl- | |
| D. | 含有大量Fe2+的溶液中:H+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
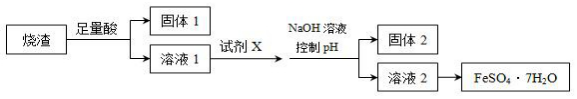
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 1molNa2O2溶于水转移的电子数为2NA | |
| D. | 含4 mol HCl的浓盐酸与足量的二氧化锰反应,生成Cl2分子的数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | NH4++H2O?NH4OH+H+ | ||
| C. | HCO3-+H2O?CO2↑+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.7 g | B. | 5.85 g | C. | 8 g | D. | 15.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
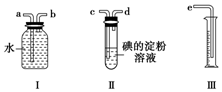 已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.
已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com