
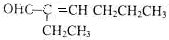 ����Ҫ����C�����������ţ�һ��ȡ�����飬��ʹ�õ��Ⱥ�˳��д�������Լ���������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫����
����Ҫ����C�����������ţ�һ��ȡ�����飬��ʹ�õ��Ⱥ�˳��д�������Լ���������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫���� ��
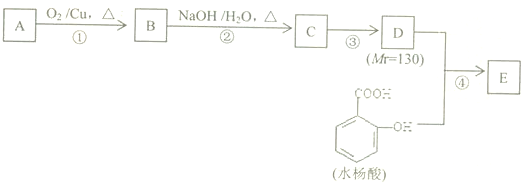
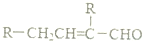
�� ���� һԪ��A��������������ԼΪ21.6%����ñ���һԪ���Ļ�ѧʽΪCnH2n+2O����Ԫ�ص���������=$\frac{16}{14n+2+16}$��100%=21.6%����n=4����A��ֻ��һ���������Ը�һԪ����1-��������ͭ�����������������£�A��������������B��ȩ����ȩ���������Ƶ�ˮ��Һ������Ӧ���� C����������Ϣ֪��C�Ľṹ��ʽΪ�� ��C��Ӧ����D��D����Է���������130����C�����������ӳɷ�Ӧ����D����D�Ľṹ��ʽΪ��CH3CH2CH2CH2CH��CH2OH��CH2CH3��D�����ǻ������ᷢ��������Ӧ����E��E�Ľṹ��ʽΪ��
��C��Ӧ����D��D����Է���������130����C�����������ӳɷ�Ӧ����D����D�Ľṹ��ʽΪ��CH3CH2CH2CH2CH��CH2OH��CH2CH3��D�����ǻ������ᷢ��������Ӧ����E��E�Ľṹ��ʽΪ�� ��������ʵĽṹ�����ʽ��н��
��������ʵĽṹ�����ʽ��н��
��� �⣺һԪ��A��������������ԼΪ21.6%����ñ���һԪ���Ļ�ѧʽΪCnH2n+2O����Ԫ�ص���������=$\frac{16}{14n+2+16}$��100%=21.6%����ã�n=4����A��ֻ��һ���������Ը�һԪ����1-��������ͭ�����������������£�A��������������B��ȩ����ȩ���������Ƶ�ˮ��Һ������Ӧ���� C����������Ϣ֪��C�Ľṹ��ʽΪ��CH3CH2CH2CH=C��CH2CH3��CHO��C��Ӧ����D��D����Է���������130����C�����������ӳɷ�Ӧ����D����D�Ľṹ��ʽΪ��CH3CH2CH2CH2CH��CH2OH��CH2CH3��D�����ǻ������ᷢ��������Ӧ����E��E�Ľṹ��ʽΪ�� ��
��
��1��ͨ�����Ϸ���֪��A�ķ���ʽΪ��C4H10O���ṹ������ʾAֻ��һ������A������Ϊ1-������F��A��Ϊͬ���칹�壬��F�������ֲ�ͬ����ԭ�ӣ�������Ϊ9��1����֪FΪ2-��-2-��������F��HBr����ȡ����Ӧ����C��CH3��3Br��
�ʴ�Ϊ��C4H10O��1-������������������C��CH3��3Br��
��2�����������£���ȩ������������ͭ��Ӧ���ɶ����ơ�������ͭ��ˮ����Ӧ����ʽΪ��CH3CH2CH2CHO+2Cu��OH��2+NaOH$\stackrel{��}{��}$ CH3CH2CH2COONa+Cu2O��+3H2O��
�ʴ�Ϊ��CH3CH2CH2CHO+2Cu��OH��2+NaOH$\stackrel{��}{��}$ CH3CH2CH2COONa+Cu2O��+3H2O��
��3��C�Ľṹ��ʽΪ��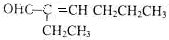 ��C�к���ȩ����̼̼˫�������ܺ���ˮ��Ӧ��Ҫ�������ֹ����ţ���Ӧ����������Һ����ȩ����Ȼ��������ˮ����̼̼˫�������鷽��Ϊ����������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫����
��C�к���ȩ����̼̼˫�������ܺ���ˮ��Ӧ��Ҫ�������ֹ����ţ���Ӧ����������Һ����ȩ����Ȼ��������ˮ����̼̼˫�������鷽��Ϊ����������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫����
�ʴ�Ϊ�� ����������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫����
����������Һ�ȼ���ȩ�����ټ�ϡ����ʹ��Һ�����Ժ���ˮ����̼̼˫����
��4���ڢ۲��ķ�Ӧ��C�����ӳɷ�Ӧ����D����������Ϊ�ӳɷ�Ӧ���ڢܲ��ķ�Ӧ��������Ӧ���������������ķ�Ӧ����֪���÷�Ӧ������Ũ���������������ȣ�ͨ�����Ϸ���֪��E�Ľṹ��ʽΪ�� ��
��
�ʴ�Ϊ���ӳɷ�Ӧ��ŨH2SO4�����ȣ� ��
��
���� ���⿼���л�����ƶϣ���Ŀ�Ѷ��еȣ���ȷ�ƶϳ�A�����ǽⱾ��ؼ�����������Ϣ���з��������ˮ������ȩ����Ϊ�״��㣬ע�����ճ����л���ṹ�����ʣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1 mol Na2CO3����Һ����Na+�ĸ���ΪNA | |
| B�� | ��״���£�1 mol�κ����������Ϊ22.4L | |
| C�� | CH4��Ħ������Ϊ16g | |
| D�� | 3.01��1023��SO2���ӵ�����Ϊ32g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PM2.5��ֱָ��Ϊ2.5pm������ | |
| B�� | PM2.5��ɵ��������������������ܲ�����彡��Σ������ | |
| C�� | �����е�PM2.5����ʾÿ����������ֱ��С�ڻ����2.5um�Ŀ�����ĺ�������PM2.5���ܵ��¿����γ����ܽ� | |
| D�� | �������е�PM2.5���˶�Ӧ���ڲ����˶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �ڢ� | C�� | �٢� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
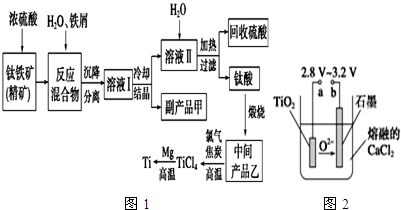
| �������� | Fe��OH��2 | TiO��OH��2 | Mg��OH��2 |
| Ksp | 8.0��10-16 | 1.0��10-29 | 1.8��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2Na+2NH3=2NaNH2+H2�� | B�� | NH3+HCl=NH4Cl | ||
| C�� | 4NH3+6NO=5N2+6H2O�� | D�� | 3SiH4+4NH3=Si3N4+12H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | �۵�/�� | �е�/�� | ���� |
| CCl4 | -23 | 76 | ��TiCl4���� |
| TiCl4 | -25 | 136 | ����ʪ����������������550��ʱ�ܱ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 172.5 kJ/mol | B�� | -172.5 kJ/mol | C�� | 393.5 kJ/mol | D�� | -393.5 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com