
| A.全部 |
| B.①③和⑤ |
| C.只有①和③ |
| D.①②和④ |
科目:高中化学 来源:不详 题型:填空题
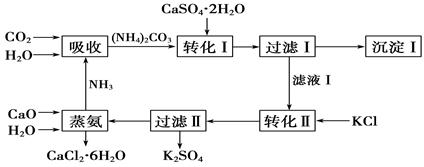
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
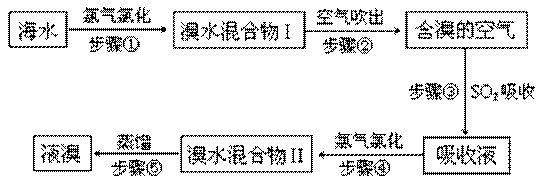
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.他们的研究对人类的生命活动具有重要意义? |
| B.他们的研究有助于探索一些包括恶性肿瘤疾病的发生机理? |
| C.他们的研究深入到了细胞的层次? |
| D.他们的研究深入到了分子、原子的层次? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
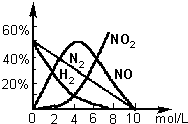
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+2价 | B.+3价 | C.+4价 | D.+5价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2 | B.N2O | C.NO | D.NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5 | B.6 | C.7 | D.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com