
下列说法正确的是( )
A.含有金属元素的晶体都是金属晶体
B.金属晶体中不一定含有金属元素
C.具有导电性的晶体一定是金属晶体
D.可以导电的物质形成的晶体不一定是金属晶体
科目:高中化学 来源: 题型:
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
查看答案和解析>>
科目:高中化学 来源: 题型:
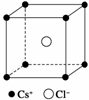
如图是CsCl晶体的晶胞结构(晶体中最小重复单元),已知晶体中两个最近的Cs+核间距离为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
A.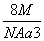 g·cm-3 B.
g·cm-3 B.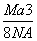 g·cm-3
g·cm-3
C.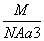 g·cm-3 D.
g·cm-3 D.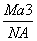 g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析正确的是( )
A.K3C60中既有离子键,又有极性键
B.1 mol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
查看答案和解析>>
科目:高中化学 来源: 题型:
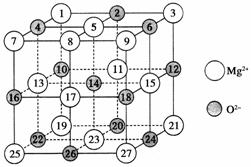
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有____________________________________________。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如上图所示,请改正图中错误:________________。
(3)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.离子键没有方向性和饱和性,共价键有方向性和饱和性
B.配位键在形成时,由成键双方各提供一个电子形成共用电子对
C.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
D.金属键中的“自由电子”为金属阳离子共用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子的空间构型是正四面体形的是( )
①CH4 ②NH3 ③CF4 ④SiH4 ⑤C2H4 ⑥CO2
A.①②③ B.①③④
C.②④⑤ D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com