


分析 (1)含有离子键的化合物为离子化合物,只含共价键的化合物为共价化合物;
(2)水是共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示其形成过程时,左边是原子的电子式,右边为水分子的电子式,中间用箭头连接;
溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示其形成过程时,左边是原子的电子式,右边为溴化镁的电子式,中间用箭头连接;
(3)水是共价化合物,由极性键结合;溴化镁是离子化合物,由离子键结合.
解答 解:(1)NaOH含有离子键和共价键,为离子化合物;
MgBr2含有离子键,为离子化合物;
Na2O2含有离子键与共价键,为离子化合物;
NH4Cl 含有离子键与共价键,为离子化合物;
H2O只含有H-O共价键,为共价化合物;
CO2、只含有C=O共价键,为共价化合物;
H2O2、只含有H-O,O-O共价键,为共价化合物;
N2为单质既不是离子化合物,也不是共价化合物;
所以:离子化合物有:NaOH、MgBr2、Na2O2、NH4Cl;共价化合物有:H2O、CO2、H2O2;
故答案为;NaOH、MgBr2、Na2O2、NH4Cl;H2O、CO2、H2O2;
(2)H2O为共价化合物,分子中氢原子与氧原子之间形成1对共用电子对,用电子式表示形成过程为 ,
,
溴化镁是离子化合物,由钠离子与镁离子构成,用电子式表示的形成过程为 ,
,
故答案为: ;
; ;
;
(3)水是共价化合物,由极性共价键结合;溴化镁是离子化合物,由离子键结合,故答案为:极性共价键; 离子键.
点评 本题考查了共价化合物、离子化合物判断,电子式书写,明确共价化合物、离子化合物概念是解题关键,注意电子式表示方法和注意问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②③④③ | B. | ①⑤③④③ | C. | ①⑤④③ | D. | ①⑤⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne互为同位素 | B. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$Ne互为同素异形体 | ||
| C. | 具有相同的中子数 | D. | $\stackrel{20}{10}$Ne与羟基(-OH)所含电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
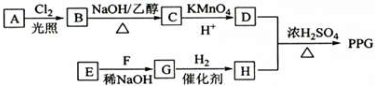
 .
. .
. .
. .
. :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通玻璃、水泥成分中都含有这三种元素 | |
| B. | 三者的单质在空气中均能稳定存在 | |
| C. | 电解熔融状态的SiO2和Al2O3可以制得Si、Al,且都有氧气生成 | |
| D. | 氧元素与另外两种元素形成的二元化合物都能与NaOH的浓溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
| A. | C9H18 | B. | C9H118O2 | C. | C8H18 | D. | C8H16O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
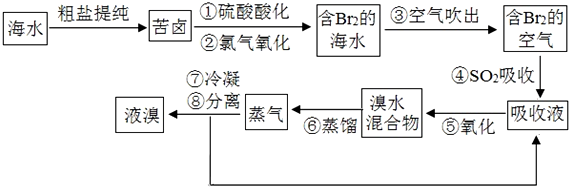
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压强不再随时间而改变时 | |
| B. | 混合气体中各组成成分的含量不再改变时 | |
| C. | 气体的总质量不再改变时 | |
| D. | 单位时间内消耗1 mol I2,同时有2 mol HI生成时 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
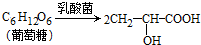
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
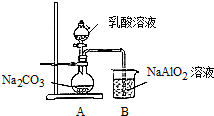
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com