
Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
|
| A. | 三者对应的氧化物均为碱性氧化物 |
|
| B. | 三者的单质放置在空气中均只生成氧化物 |
|
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
|
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
考点:
常见金属元素的单质及其化合物的综合应用;原电池和电解池的工作原理;盐类水解的应用.
专题:
基本概念与基本理论;元素及其化合物.
分析:
A、根据Al、Fe、Cu三者对应的氧化物各自所属类别来回答;
B、根据Al、Fe、Cu三者放在空气中所发生的反应来回答;
C、根据AlCl3、FeCl3、CuCl2三种溶液直接蒸干时所得到的产物进行分析;
D、根据电解原理,阴极上析出的金属应按照其对应的阳离子的放电顺序来析出.
解答:
解:A、铝对应的氧化物Al2O3是两性氧化物,故A错误;
B、Fe还可以形成复杂的氢氧化物,Cu可以形成碱式碳酸铜等,故B错误;
C、因为AlCl3、FeCl3、CuCl2的溶液加热时都水解生成沉淀和HCl气体了,HCl挥发了,所以得到的是各自的沉淀物,制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法,故C正确;
D、根据电解原理,阴极上离子的放电顺序是:Cu2+>H+>Fe2+>Al3+,Fe2+和Al3+不放电,Fe3+得电子成为Fe2+,不会析出铁,所以铁和Al不可以,因为它们比H活泼,只有Cu可以,故D错误.
故选C.
点评:
本题考查了常见的金属单质的性质、电解原理以及盐类水解的应用知识,是一道综合型题目.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
Na Cu Al Fe
熔点(℃) 97.5 1083 660 1535
沸点(℃) 883 2595 2200 3000
你判断其中不能形成合金的是( )
A. Cu和Al B. Fe和Cu C. Fe和Na D. Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 最终溶液:c(Na+)=1.5mol/L
B. 标准状况下,反应过程中得到6.72 L气体
C. 最终溶液:c(Na+)=c(Cl﹣)
D. 最终得到7.8 g沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
|
| A. | N2的电子式: |
|
| B. | S2﹣的结构示意图: |
|
| C. | 质子数为53,中子数为78的碘原子: |
|
| D. | 邻羟基苯甲酸的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到.下列说法不正确的是( )
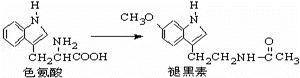
|
| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 |
|
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 |
|
| C. | 在一定条件下,色氨酸可发生缩聚反应 |
|
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧是地壳中含量最多的元素
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内O﹣H键、分子间的范德华力和氢键从强到弱依次为 . 沸点比
沸点比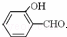 高,原因是 形. .
高,原因是 形. .
(3)H+可与H2O形成H3O+,H3O+中O原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因是 .
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO的密度为ag•cm﹣3,NA表示阿伏家的罗常数,则CaO晶胞的体积为 .
cm3.
查看答案和解析>>
科目:高中化学 来源: 题型:
现有室温下两种溶液,有关叙述正确的是
| 编号 | ① | ② |
| pH | 12 | 2 |
| 溶液 | 氢氧化钠溶液 | 醋酸溶液 |
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度: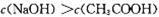
C.两种溶液等体积混合后: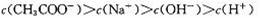
D.加水稀释相同倍数后: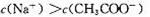
查看答案和解析>>
科目:高中化学 来源: 题型:
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
| B | Na2O2使酚酞溶液变红 | Na2O2使品红溶液褪色 |
| C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
| D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com