
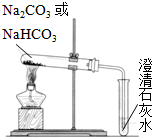
 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
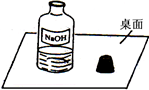 (2013?天河区一模)一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究.
(2013?天河区一模)一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究.| 实验步骤 | 预期现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备过碳酸钠时可釆用冷水浴控制反应温度 | B、过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 | C、过碳酸钠应密封保存,放置于冷暗处 | D、过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均可溶于水 | B、水溶液滴入酚酞,均能变红 | C、均能与盐酸反应 | D、受热均易分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com