
【题目】臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。
2O3。
(1)若上述反应中有30%的氧气转化为臭氧,求所得混合气体的平均摩尔质量______(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,求其中臭氧的体积___________。
(3)加热条件下,O3、O2都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896 L(标准状况下)通入盛有20.0 g铜粉的反应器中,充分加热后,混合气体被完全吸收,粉末的质量变为21.6 g。求原混合气体中臭氧的体积分数___________。
【答案】35.6 g/mol 3 L 50%
【解析】
(1)假设反应前氧气的物质的量是100mol,若在上述反应中有30%的氧气转化为臭氧,则反应后含有O2的物质的量是70mol,反应后产生的气体含有O3的物质的量是20mol所得混合气的平均摩尔质量M=![]() =
=![]() =35.6g/mol;
=35.6g/mol;
(2)根据反应方程式3O2=2O3可知若有3L氧气反应,能够产生2L的O3,则反应后气体体积减少1L,现在将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,减少了8L-6.5 L=1.5 L,所以其中臭氧为2×1.5 L=3L;
(3)n(气体)=![]() =0.04mol,固体质量增加了21.6 g-20.00g=1.6g,则n(O)=
=0.04mol,固体质量增加了21.6 g-20.00g=1.6g,则n(O)=![]() =0.1mol。假设混合气体中含O2、O3的物质的量分别是x、y,则x+y=0.04mol;2x+3y=0.1mol。解得x=0.02mol,y=0.02mol,所以混合气体中臭氧的体积分数为
=0.1mol。假设混合气体中含O2、O3的物质的量分别是x、y,则x+y=0.04mol;2x+3y=0.1mol。解得x=0.02mol,y=0.02mol,所以混合气体中臭氧的体积分数为![]() ×100%=50%。
×100%=50%。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中的位置如图所示。下列推断正确的是( )
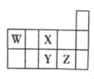
A. 原子半径:Z>Y>X
B. 元素非金属性:Z>Y>X
C. 最高价氧化物对应水化物的酸性:Z>Y>W
D. WH4与Z元素的单质在光照时发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
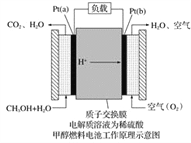
请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 30℃ |
B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |
C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲醇化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJmol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJmol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为_____。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
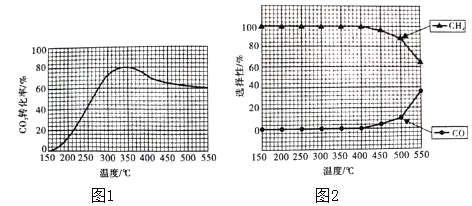
①下列说法不正确的是_____(填序号)。
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为____(用a、V表示)。
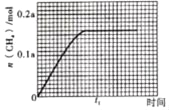
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。____
(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数K=![]() .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体Na2SO3受热分解生成两种正盐,实验流程和结果如下:
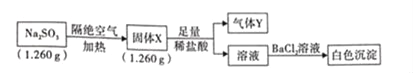
已知:气体Y是一种纯净物,在标准状况下密度为1.518gL﹣1.请回答下列问题:
(1)气体Y的电子式为_____。
(2)实验流程中,Na2SO3受热分解的化学方程式为_____。
(3)另取固体X试样和Na2SO3混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为_____(不考虑空气的影响)。
(4)Na2SO3长期露置在空气中,会被氧化成Na2SO4,检验Na2SO3是否变质的实验操作是_____。
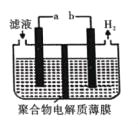
(5)某研究性学习小组通过图所示装置,利用电化学方法处理上述流程中产生的气体Y.基本工艺是将气体Y通入FeCl3,待充分反应后过滤,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用。则与a相连的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)
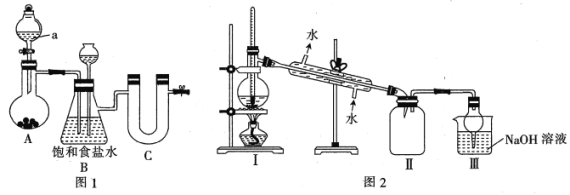
I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为_________________________________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用。
(3)试剂Ⅹ可能为___________(填标号)。
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________。
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________。
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________。
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为Fe2++Cr2O72-+H+→Cr3++Fe3++H2O(未配平)
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com