
 2SO3(g)��������Ӧ���ȡ��������������ͬ���ܱ�����������ͼ��ʾͶ�ϣ�����400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����
2SO3(g)��������Ӧ���ȡ��������������ͬ���ܱ�����������ͼ��ʾͶ�ϣ�����400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����
| A������I������ƽ�ⳣ����ͬ |
| B������II����������Ӧ������ͬ |
| C���������еķ�Ӧ��ƽ��ʱ��SO3�����������II > III |
| D����������SO2��ת��������������SO3��ת����֮��С��1 |
 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3 (g) ��H =��a kJ��mol��1��a��0�������º����£���10L���ܱ������м���0.1molSO2��0.05molO2������2min�ﵽƽ��״̬����Ӧ�ų�����x kJ
2SO3 (g) ��H =��a kJ��mol��1��a��0�������º����£���10L���ܱ������м���0.1molSO2��0.05molO2������2min�ﵽƽ��״̬����Ӧ�ų�����x kJ| A����Ӧ�ų�����x="0.05" a |
| B����Ӧ�ﵽƽ��״̬ʱ��2v (SO2)����=" v" (O2) ���� |
| C�������º�ѹ�£���10L���ܱ������м���0.1molSO2��0.05molO2��ƽ���Ӧ�ų�������y kJ����y < x |
| D�������¶ȣ�ƽ�ⳣ����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO (g)+H2 (g)����H="+131" kJ��mol-1
CO (g)+H2 (g)����H="+131" kJ��mol-1| ���� ��� | c(H2O) /mol��L-1 | c(CO) /mol��L-1 | c(H2) /mol��L-1 | v����v���Ƚ� |
| �� | 0.06 | 0.60 | 0.10 | v��=v�� |
| �� | 0.06 | 0.50 | 0.40 | �� |
| �� | 0.12 | 0.40 | 0.80 | v��<v�� |
| �� | 0.12 | 0.30 | �� | v��=v�� |
 CH3OH(g)����H>0,���ϳɼ״���Ӧ��ϵ��ͨ������CO��ƽ�����������ƶ�,��Сѹǿ��ƽ�����������ƶ�,�����¶���ƽ�������������������ƶ�(����������ҡ�����)��
CH3OH(g)����H>0,���ϳɼ״���Ӧ��ϵ��ͨ������CO��ƽ�����������ƶ�,��Сѹǿ��ƽ�����������ƶ�,�����¶���ƽ�������������������ƶ�(����������ҡ�����)�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g)��D(g) ��H��0����ش���������:
C(g)��D(g) ��H��0����ش���������:�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3R(g) ��H>0����ͼ��ʾ��������¶ȡ�ѹǿ�ı仯��������Ӧ��Ӱ�졣���б�����ȷ����( )
3R(g) ��H>0����ͼ��ʾ��������¶ȡ�ѹǿ�ı仯��������Ӧ��Ӱ�졣���б�����ȷ����( )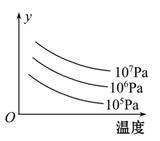
| A���÷�Ӧ��ƽ�������ʵ��Ĵ��������G��ת���� |
| B���ﵽƽ����������м���L��ƽ�������ƶ���G��ת�������� |
| C��ͼ�е�y������ƽ��������G���������� |
| D��ͼ�е�y�����Ǵﵽƽ��ʱG��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KԽ��Ӧ���ת����ԽС |
| B��K�뷴Ӧ���Ũ���й� |
| C��K���������Ũ���й� |
| D��K���¶��й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H����92.6 kJ/mol��ʵ������ʼ��ƽ��ʱ���й����������ʾ����������������ǣ�������
2NH3��g������H����92.6 kJ/mol��ʵ������ʼ��ƽ��ʱ���й����������ʾ����������������ǣ�������| | ��ʼʱ�����ʵ����� ������mol�� | �ﵽƽ��ʱ�����仯 | ||
| ������� | N2 | H2 | NH3 | |
| �� | 1 | 3 | 0 | �ų�23.15 kJ���� |
| �� | 0.9 | 2.7 | 0.2 | �ų�Q kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����Ӧ�ﵽƽ��ʱ, X��ת����Ϊ50% |
B����Ӧ�ɱ�ʾΪ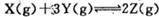 |
| C������ѹǿ��ʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ |
| D���ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ᷴӦ�������� |
| B����������ȼ�� |
| C���������ṯ��Һ�б����γ������� |
| D��һ���¶��£������������Ʒ�Ӧ�Ƶý����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com