
| A. | 核磁共振谱 | B. | 红外光谱 | C. | 质谱 | D. | 紫外光谱 |
分析 质谱仪其实是把有机物打成很多小块(有规律的,按照各官能团打开,所以一般有点经验的也能从小数字看出这种物质大概含有哪些官能团),会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量,据此进行解答.
解答 解:A.核磁共振是检验不同环境的H的数量.有多少种不同的H,就有多少个峰,各个峰的高度大致上能显示各种H的数量比例,无法确定有机物的相对分子质量,故A错误;
B.红外光谱是用于鉴定有机物中所含的各种官能团的,双键,三键,羟基,羧基羰基等等,故B错误;
C.质谱仪其实是把有机物打成很多小块,会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量,故C正确;
D.紫外光谱是为了了解未知物的初步的化学结构.从光谱信息中得到该物质的基团或者化学键产生的吸收情况,初步判断该物质的结构信息,故D错误;
故选C.
点评 本题考查了常见确定有机物分子组成的方法,题目难度不大,明确核磁共振氢谱、红外光谱、质谱仪、紫外光谱等的含义为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯固定的熔沸点,其可由乙烯通过加聚反应合成 | |
| B. | 有机物的种类繁多,分子中含有碳、氢元素的物质即为有机物 | |
| C. | 石油的分馏和煤的干馏均属于物理变化 | |
| D. | 不是所有的有机物中都含有一种或多种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
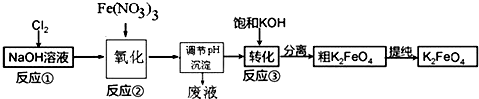

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
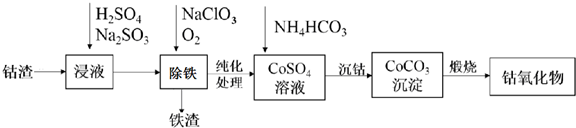
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③ | B. | ③>①>② | C. | ③>②>① | D. | ②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
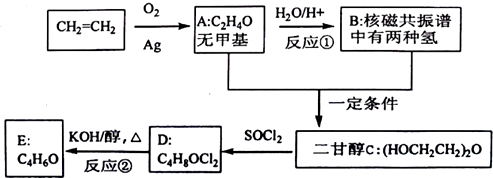
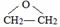 、DClCH2CH2OCH2CH2Cl.
、DClCH2CH2OCH2CH2Cl.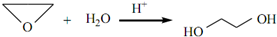 ;反应②ClCH2CH2OCH2CH2Cl+2KOH$→_{△}^{乙醇}$CH2=CH-O-CH=CH2+2KCl+2H2O.
;反应②ClCH2CH2OCH2CH2Cl+2KOH$→_{△}^{乙醇}$CH2=CH-O-CH=CH2+2KCl+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | AB的消耗速率等于A2的消耗速率 | |
| C. | 容器内,3种气体AB、A2、B2共存 | |
| D. | 容器中各组分的体积分数不随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com