���
�⣺��1������������������ķ�Ӧ������������������������������������Ӧ����ʽΪ2Al+2 NaOH+2 H
2O=2 NaAlO
2+3 H
2����
�ʴ�Ϊ��2Al+2 NaOH+2 H
2O=2 NaAlO
2+3 H
2����
��2���ɷ�Ӧ�ݱ�״����11.2L CH
4��ˮ��Ӧ�������������ʵ���Ϊ
��3=1.5mol
�ָ���2Na+2 H
2O=2 NaOH+H
2����Ҫ����1.5mol��������Ҫ��3mol������Ҫ�Ƶ�����Ϊ3mol��23g/mol=69g��
�ʴ�Ϊ��69��
��3���ٺ��¡����������£�
A���������������ݻ�Ϊ4L����ﵽƽ��ʱ����Ϊ��Чƽ�⣬����ֵĺ�����Ũ����ȣ���ʱ������Ũ��Ϊc
1��Ȼ���������ݻ���С��2L����ƽ�ⲻ�ƶ���2c
1=1.5mol/L������ѹǿ����ƽ�����������ƶ���������Ũ����������2c
1��1.5mol/L����A��ȷ��
B������2mol�����൱�ڼ�����1mol������3mol������������Ϊ3mol H
2��2mol N
2�����ڱ���Ӧ�ﵪ�������ʵ�����С�����ɵİ��������ʵ�����С�����Ԧ�
3����
1����B����
C����Ӧǰ�������壬�������ݻ�����2L�����л�����������Ϊ��2�������ݦ�=
��֪��2��
1=��
2����C��ȷ��
��ѡAC��
�ڼ������У���Ӧǰ����Ũ��Ϊ��c��H
2��=
=1.5mol/L��������Ũ��Ϊ��
=1mol/L���ﵽƽ��ʱ������Ũ�ȱ仯Ϊ����1-c
1��mol/L��
�ɻ�ѧƽ�������ʽ�ɵã�3H
2��g��+N
2��g��?2NH
3��g��
��Ӧǰ��mol/L����1.5 1 0
Ũ�ȱ仯����mol/L����3��1-c
1�� ��1-c
1�� 2��1-c
1��
��Ӧ��mol/L����1.5-3��1-c
1�� 1-��1-c
1�� 2��1-c
1��
�ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K=
��
�ʴ�Ϊ��
��
��4����CH
4��g��+H
2O��g���TCO��g��+3H
2��g����H=+206.2kJ?mol
-1��CH
4��g��+CO
2��g���T2CO��g��+2H
2��g����H=+247.4kJ?mol
-1�١�2-�ڵõ�CH
4��g��+2H
2O��g���TCO
2��g��+4H
2��g����H=+165kJ?mol
-1 ��
�ʴ�Ϊ��CH
4��g��+2H
2O��g���TCO
2��g��+4H
2��g����H=+165kJ?mol
-1��
��5�������������������ʧ�������ɸ���������ӣ��缫��ӦʽΪ��MnO
42--e
-=MnO
4-���ʴ�Ϊ��MnO
42--e
-=MnO
4-��
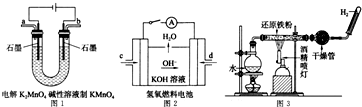
������ȼ�ϼ��Ե���У�����ʧ���Ӻ����������ӷ�Ӧ����ˮ��ͼƬ��������������d�缫�ƶ���˵��d�缫�����������ʴ�Ϊ��d��
������ˮ�����ڸ����·�Ӧ�������������������������ݷ�Ӧ����֪���÷�Ӧ�в�����δ�μӷ�Ӧ����ʣ������������ӷ�Ӧ���ɶ��������ӣ����ӷ���ʽΪ��2Fe
3++Fe=3Fe
2+������˵�����ܣ��ʴ�Ϊ�������ܣ� 2Fe
3++Fe=3Fe
2+��




 ����ǰ����������Ԫ��X��Y��Z��E��F��G�����ǵ�ԭ��������������G�⣬��������Ԫ�ض��Ƕ�����Ԫ�أ�X��Y��E����Ԫ����ɵĻ�������ʵ���ҳ���ȼ�ϣ�Ҳ��һ�ּ�ͥ������Ʒ����Ҫ�ɷ֣�ȡF�Ļ���������ɫ��Ӧʵ�飬����ɫ�ʻ�ɫ��G�ĵ����������г�����һ�ֽ�����GE�Ǻ�ɫ���壮G2E�Ǻ�ɫ���壮��ش��������⣺
����ǰ����������Ԫ��X��Y��Z��E��F��G�����ǵ�ԭ��������������G�⣬��������Ԫ�ض��Ƕ�����Ԫ�أ�X��Y��E����Ԫ����ɵĻ�������ʵ���ҳ���ȼ�ϣ�Ҳ��һ�ּ�ͥ������Ʒ����Ҫ�ɷ֣�ȡF�Ļ���������ɫ��Ӧʵ�飬����ɫ�ʻ�ɫ��G�ĵ����������г�����һ�ֽ�����GE�Ǻ�ɫ���壮G2E�Ǻ�ɫ���壮��ش��������⣺