
【题目】如图是实验室制取SO2,并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验)。请回答下列问题:
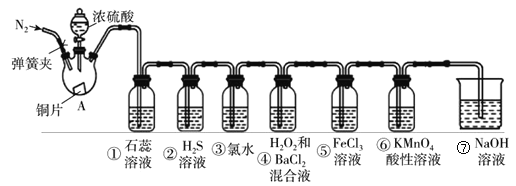
(1)在A中发生反应的化学方程式为:__________。
(2)③中化学反应方程式____,④中产生白色沉淀,离子方程式为________,⑤中的现象见溶液由黄色变为浅绿色,其反应的离子方程式为_________。
(3)能体现出SO2还原性的实验序号是____。
(4)实验结束后需要通入N2,其目的____。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O SO2+Cl2+2H2O=H2SO4+2HCl H2O2+SO2+Ba2+=BaSO4↓+2H+ 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③④⑤⑥ 把装置内的SO2全部赶入⑦被NaOH溶液吸收,防止SO2污染环境
CuSO4+SO2↑+2H2O SO2+Cl2+2H2O=H2SO4+2HCl H2O2+SO2+Ba2+=BaSO4↓+2H+ 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③④⑤⑥ 把装置内的SO2全部赶入⑦被NaOH溶液吸收,防止SO2污染环境
【解析】
实验室制SO2并验证SO2某些性质,A中硫酸与Cu混合加热反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中SO2与H2S在溶液发生氧化还原反应,SO2被还原,H2S被氧化生成单质S;③中氯水与SO2发生氧化还原反应产生HCl和H2SO4,氯水褪色;④中SO与H2O2发生氧化还原反应产生H2SO4,H2SO4与BaCl2反应产生BaSO4白色沉淀;⑤中二氧化硫与FeCl3溶液发生氧化还原反应产生FeCl2、HCl和H2SO4,溶液黄色褪去;⑥中二氧化硫被高锰酸钾氧化变为H2SO4,KMnO4被还原为无色MnSO4而使高锰酸钾溶液褪色;⑦为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,据此分析解答。
(1)在A中Cu与浓硫酸混合加热发生氧化还原反应,产生SO2,发生反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)③中Cl2、SO2、H2O反应产生HCl和H2SO4,该反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;④中SO2先与H2O2发生氧化还原反应产生H2SO4,然后是反应产物H2SO4与BaCl2反应产生BaSO4白色沉淀,总反应的离子方程式为H2O2+SO2+Ba2+=BaSO4↓+2H+;⑤中SO2与FeCl3溶液发生氧化还原反应产生FeCl2、HCl和H2SO4,使溶液由黄色变为浅绿色,其反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)若反应中SO2中S元素化合价升高,失去电子,则表现还原性,在上述反应中能体现出SO2还原性的实验序号是③④⑤⑥;
(4)SO2是大气污染物,在实验结束时若滞留在反应装置中会导致大气污染,因此反应结束时向装置内通入N2,就可以把装置的SO2全部赶入⑦中被NaOH溶液吸收,防止SO2污染环境。


科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢、氧三种元素组成,其红外光谱图有C—H键、H—O键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式可能是
A. CH3CH2CH2OHB.  C. CH3CH2OCH3D. CH3CH2CHO
C. CH3CH2OCH3D. CH3CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_________,目的是____________,实验中浓硫酸的作用是___________________。
(2)反应中加入过量的乙醇,目的是__________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是_______________________。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物。下列框图是分离操作步骤流程图:

则试剂a是:____________,分离方法I是____________,分离方法II是____________,试剂b是______________,分离方法III是____________。
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为上述实验没有成功。
试解答下列问题:
①甲实验失败的原因是:__________________________________________________________
②乙实验失败的原因是:_________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
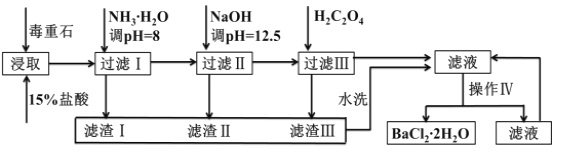
Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____(填“正”或“负”)极。F电极上的电极反应式为________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______。


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是

A. 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大。
B. 根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强。
C. 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同。
D. 元素K、H、G分别形成的简单离子的半径逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
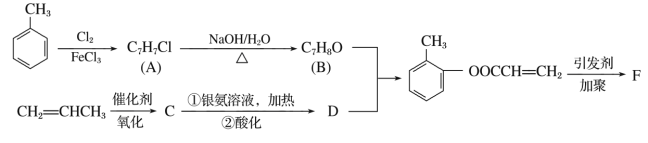
回答下列问题:
(1)由A生成B的反应类型是:___________________;
(2)F的结构简式为______________。
(3)写出C与银氨溶液共热(即第①步)的化学方程式:_________
(4)化合物D不能发生的反应有________(填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(5)B的含苯环结构的同分异构体还有________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8,由B生成C的化学方程式为__________。
(2)下图为人体在某项生理过程中所发生的化学反应示意图。
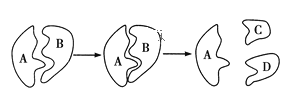
①图中标有字母的物质中,________代表酶,其化学本质是__________,基本组成单位是__________。
②如果B代表蔗糖,则C和D各代表__________。
③下列关于葡萄糖与蔗糖相比较的说法中错误的是 (______)
A.它们的分子式不同,但化学组成元素相同
B.蔗糖能水解,葡萄糖却不能
C.它们是同分异构体
D.葡萄糖是单糖,蔗糖是二糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com