
| A. | ③④ | B. | ①③④ | C. | ①②③④ | D. | 全部 |
分析 将固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同,说明该物质较稳定,加热不分解,且不水解生成挥发性酸,据此分析解答.
解答 解:①胆矾溶于水后,将溶液蒸发结晶再灼烧得到硫酸铜而不是胆矾,所以得不到原物质,故错误;
②氯化铝溶于水后,将溶液蒸发结晶时促进氯化铝水解,氯化氢具有挥发性,所以蒸发结晶得到的固体是氢氧化铝,再灼烧氢氧化铝得到氧化铝,所以得不到原物质,故错误;
③硫酸铝溶于水后,蒸发过程中硫酸铝水解得到硫酸和氢氧化铝,但硫酸没有挥发性,所以蒸发结晶得到的固体是硫酸铝,硫酸铝较稳定,在灼烧时不分解,所以最终得到的固体是原物质,故正确;
④纯碱溶于水后,蒸发结晶过程中得到的固体是碳酸钠,碳酸钠较稳定,加热时不分解,所以最终得到原物质,故正确;
⑤氯化铜溶于水后,蒸发结晶过程中氯化铜水解生成氢氧化铜和氯化氢,蒸发促进氯化氢挥发,所以蒸发结晶得到的固体是氢氧化铜,氢氧化铜不稳定,在灼烧时分解生成氧化铜,所以最终得到的固体不是原物质,故错误;
故选A.
点评 本题以盐类水解为载体考查物质的性质,只有性质稳定、水解不生成挥发性酸的盐蒸发结晶得到原来物质,水解生成挥发性酸的盐蒸发结晶灼烧时得到氧化物.


科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 常温下三者加入浓硫酸中均无明显现 | |
| D. | Fe2O3与Fe3O4互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Fe3+溶液中:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
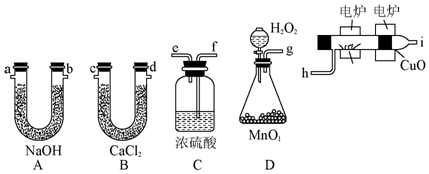
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
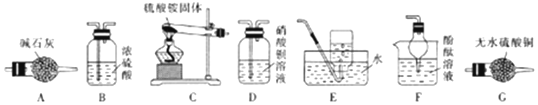
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
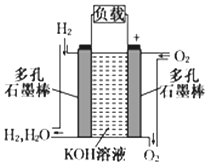 被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该反应中反应物的总能量大于生成物的总能量 | |
| B. | 该反应中反应物的总能量小于生成物的总能量 | |
| C. | 该反应发生时,一定不需要加热 | |
| D. | 如果该反应开始后停止加热,反应一定能继续进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com