
【题目】金属铬(Cr)常用于制造不锈钢和仪器仪表的金属表面镀铬。由FeCr2O4(亚铬酸亚铁)制备Cr的流程如下(+6价铬元素在酸性条件下以Cr2O72-的形式存在)。下列说法错误的是
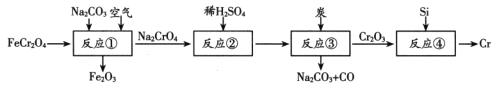
A.FeCr2O4中Cr元素的化合价为+3价
B.反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为3:1
C.反应③的化学方程式为Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
D.反应④中的Si可用Al来代替
【答案】B
【解析】
反应①为:4FeCr2O4+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2↑,反应②为:2Na2CrO4+H2SO4= Na2Cr2O7+ Na2SO4+H2O,反应③为:Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑,反应④为3Si+ 2Cr2O3
Cr2O3+Na2CO3+CO↑,反应④为3Si+ 2Cr2O3![]() 4Cr+3SiO2,然后分析。
4Cr+3SiO2,然后分析。
A.FeCr2O4(亚铬酸亚铁)中各元素的化合价之和等于0,设Cr元素的化合价为x,+2+2x+4×(-2)=0则Cr元素的化合价为+3价,故A正确;
B.根据反应①为:4FeCr2O4+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2↑,反应①中参加反应的FeCr2O4和Na2CO3的物质的量之比为1:2,故B错误;
C.+6价铬元素在酸性条件下以Cr2O72-的形式存在,反应③的化学方程式为Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑,故C正确;
Cr2O3+Na2CO3+CO↑,故C正确;
D.反应④为3Si+ 2Cr2O3![]() 4Cr+3SiO2,Al可以和三氧化二铬发生,Si可用Al来代替,故D正确;
4Cr+3SiO2,Al可以和三氧化二铬发生,Si可用Al来代替,故D正确;
答案选B。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质转化的化学方程式。

①_____________________________________________,
②_____________________________________________,
③_____________________________________________,
(2)写出下列物质转化的化学方程式。

①_____________________________________________,
②_____________________________________________,
③_____________________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是
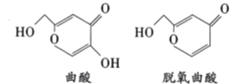
A.两物质都能使溴的四氯化碳溶液褪色
B.曲酸经消去反应可得脱氧曲酸
C.1mol脱氧曲酸最多能与3molH2发生加成反应
D.曲酸与脱氧曲酸中含有相同种类的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
A. Q1=2Q2=92.4B. 92.4=Q1<2Q2
C. 92.4>Ql>2Q2D. Q1=2Q2<92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是

A.Ksp(Ag2CrO4)的数值为10-9.92
B.a点表示的是Ag2CrO4的不饱和溶液
C.沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数为1012.08
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国采用的Cu2O/TiO2–NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:
(1)钛(Ti)的基态原子M能层中能量不同的电子有_____________种。
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、![]() 分子中O-H键的极性最强的是_____________。
分子中O-H键的极性最强的是_____________。
②C、N、O三种元素的电负性由大到小的顺序是_____________。
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为_____________mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是_____________。
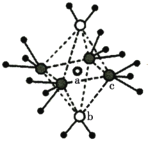
(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为_____________gcm-3 (用含r和NA数学表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
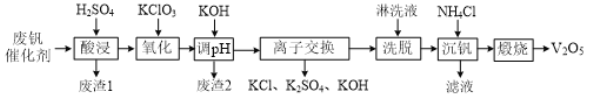
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 ClO2是一种强氧化性气体,在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图所示装置对其进行制备、收集、吸收并制取NaClO2。

(1)仪器A的名称是________。
(2)图中装置有一明显错误,请指出:________。
(3)打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3,写出D中所发生反应的离子方程式:________。
(4)E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:________。
(5)写出一种提高ClO2吸收率的方法:________。
(6)E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2-,当pH≤2时,ClO2-能被I还原。请补充完整检验E装置溶液中存在少量ClO2-的实验方案:取一定体积E装置中的溶液于分液漏斗中,________,则溶液中存在ClO2-。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com