
| A. | 鱼 | B. | 大米 | C. | 葡萄 | D. | 植物油 |
科目:高中化学 来源: 题型:解答题
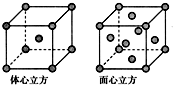 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | HBr | FeCl3 | H2SO4 | Ca(OH)2 |
| 弱电解质 | HF | HCOOH | BaSO4 | HI |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合光照反应后所得产物为4种 | |
| B. | 乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 | |
| C. | 通入适量的H2可以除去乙烷中混有的乙烯杂质 | |
| D. | 制备乙酸乙酯可用饱和碳酸钠溶液收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 钇钡铜氧的晶胞结构如图.研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价.根据图示晶胞结构,推算晶体中Y、Ba、Cu和O原子个数比,确定其化学式为YBa2Cu3O7.
钇钡铜氧的晶胞结构如图.研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价.根据图示晶胞结构,推算晶体中Y、Ba、Cu和O原子个数比,确定其化学式为YBa2Cu3O7.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com