
【题目】下列说法正确的是( )
A.在离子化合物中,可能含共价键
B.在共价化合物中,可能含离子键
C.含共价键的化合物一定是共价化合物
D.含离子键的化合物不一定是离子化合物
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质的电离方程式如下:
HClO4=H++ClO4-;
Ba(OH)2=Ba2++2OH-;
Fe2(SO4)3=2Fe3++3SO42-;
KHSO4=K++H++SO42-
属于酸的物质是__________(写化学式);属于碱的物质是__________;属于盐的物质是______________。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是________________________________。
②上述物质中既不是电解质也不是非电解质的是_________________
③写出纯碱的电离方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是
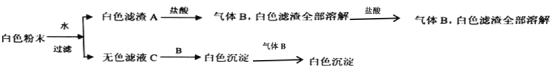
A. K2SO4、CuSO4一定不存在
B. BaCl2一定不存在
C. K2SO4、CaCO3、BaCl2一定存在
D. 滤液C中只含有BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。
Ⅰ.若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
Ⅱ.若向实验Ⅰ的四支试管中分别加盐酸,B盐溶液有沉淀产生E,D盐溶液有无色无味气体逸出。
根据实验Ⅰ、Ⅱ回答下列问题:
(1)C的名称为___________;D的化学式为______________。
(2)写出盐酸+B反应的离子方程式__________________,化学方程式与盐酸+D反应具有相同的离子方程式。
(3)将沉淀E过滤并洗涤,如何验证沉淀E已洗涤干净_____________________________。
(4)为检测C盐的一些性质,需配制240 mL 0.2 mol/L NaOH溶液,请回答下列问题:
①经计算,需用托盘天平称量固体NaOH的质量为__________g。
②在配制NaOH溶液时除烧杯、玻璃棒外,还需使用的玻璃仪器有________和_________。
③将NaOH浓溶液先____________,再转移到容量瓶中,否则溶液浓度__________(填“偏高”或“偏低”)。
④配制NaOH溶液时定容的操作:加蒸馏水距离刻度线__________处,改用_________滴加,至_______________与刻度线相切。
⑤取出配制好的溶液150mL,可以中和质量分数为36.5%,密度为1.20g/mL的盐酸的体积为____mL,配制该盐酸需HCl的体积为________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙。反应的方程式如下:2Al+Fe2O3![]() 2Fe+Al2O3,下列说法不正确的是( )
2Fe+Al2O3,下列说法不正确的是( )
A. 氧化剂是Fe2O3,氧化产物是 Al2O3。
B. 被氧化的元素是铝,被还原的元素是铁。
C. 当转移的电子为0.3mol时,参加反应的铝为2.7g
D. Fe2O3既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
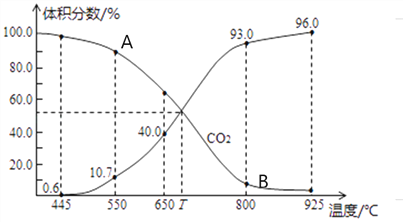
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
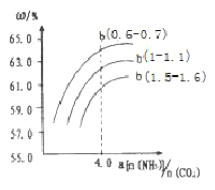
①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com