
����Ŀ��������H(![]() )����һ�ֳ����Ŀ��᳦��ҩ���ͼ�����÷�����AΪԭ������Ʊ�H��·�ߡ�
)����һ�ֳ����Ŀ��᳦��ҩ���ͼ�����÷�����AΪԭ������Ʊ�H��·�ߡ�
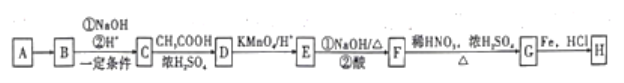
��֪����A�������ܶ�����ͬ�����������ܶȵ�46����
��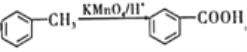 ��
��
�ش���������
��1��A��������_______��C�к��й����ŵ�������____��
��2��д��C����D�Ļ�ѧ����ʽ��______���÷�Ӧ��������______��
��3��G�Ľṹ��ʽ��______��
��4�����C��D��E��F������Ӧ��Ŀ����______��
��5��������X��D��ͬ���칹�壬��������������X��______�֡�
�ٷ����廯����ұ�����������ȡ�������ܷ���ˮ�ⷴӦ
д�����к˴Ź���������ʾ��4�ֲ�ͬ��ѧ��������ԭ�ӣ������֮��Ϊ3��3��2��2������X�Ľṹ��ʽ��______��
��6����֪![]() �ױ��������������������ʱ������һ��ȡ��������ȡ����������ڡ���λ�����������������Ȼ�ʱ��ȡ���ڼ�λ���ݴ�д����AΪԭ���Ʊ�������
�ױ��������������������ʱ������һ��ȡ��������ȡ����������ڡ���λ�����������������Ȼ�ʱ��ȡ���ڼ�λ���ݴ�д����AΪԭ���Ʊ�������![]() �ĺϳ�·��(���Լ���ѡ)___________��
�ĺϳ�·��(���Լ���ѡ)___________��
���𰸡��ױ� �ǻ� ![]() +CH3COOH
+CH3COOH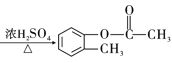 +H2O ȡ����Ӧ
+H2O ȡ����Ӧ ![]() �������ǻ������ֹ���ǻ��������� 11
�������ǻ������ֹ���ǻ��������� 11 ![]() ��
��![]()
![]()
��������
A�������ܶ�����ͬ�����������ܶȵĵ�46����������ͬ�����£��ܶ�֮�ȵ���Ħ������֮�ȣ����Ƴ�A��Ħ������Ϊ46��2g��mol��1=92g��mol��1��AΪ�����������ñ�ͬϵ���ͨʽ���ó�A�ķ���ʽΪC7H8��AΪ�ױ�������B��C���������Ƴ�A��B����ȡ����Ӧ������±��ԭ�ӣ�D��E���������Լ���Ϣ�ڣ��Ƴ�A����ȡ����Ӧ���ڱ���������±ԭ�ӣ�����H�Ľṹ��ʽ��±��ԭ�����뵽������λ������������-Br������B�Ľṹ��ʽΪ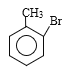 ������B��C������������±������ˮ�ⷴӦ��ǿ�������ᣬ�ó�C�Ľṹ��ʽ
������B��C������������±������ˮ�ⷴӦ��ǿ�������ᣬ�ó�C�Ľṹ��ʽ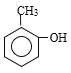 ��C��CH3COOH����������Ӧ���Ƴ�D�Ľṹ��ʽΪ
��C��CH3COOH����������Ӧ���Ƴ�D�Ľṹ��ʽΪ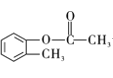 �����ø�����ص�ǿ�����ԣ�����CH3�����ɣ�COOH��E��NaOH��������ˮ�⣬��F�Ľṹ��ʽΪ
�����ø�����ص�ǿ�����ԣ�����CH3�����ɣ�COOH��E��NaOH��������ˮ�⣬��F�Ľṹ��ʽΪ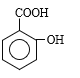 ������F����G�ķ�Ӧ������Ӧ����ȡ����Ӧ�����룭NO2����G�Ľṹ��ʽΪ
������F����G�ķ�Ӧ������Ӧ����ȡ����Ӧ�����룭NO2����G�Ľṹ��ʽΪ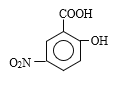 ��Ȼ������ԭ��Ӧ���õ�����ݴ˷�����
��Ȼ������ԭ��Ӧ���õ�����ݴ˷�����
A�������ܶ�����ͬ�����������ܶȵĵ�46����������ͬ�����£��ܶ�֮�ȵ���Ħ������֮�ȣ����Ƴ�A��Ħ������Ϊ46��2g��mol��1=92g��mol��1��AΪ�����������ñ�ͬϵ���ͨʽ���ó�A�ķ���ʽΪC7H8��AΪ�ױ�������B��C���������Ƴ�A��B����ȡ����Ӧ������±��ԭ�ӣ�D��E���������Լ���Ϣ�ڣ��Ƴ�A����ȡ����Ӧ���ڱ���������±ԭ�ӣ�����H�Ľṹ��ʽ��±��ԭ�����뵽������λ������������-Br������B�Ľṹ��ʽΪ ������B��C������������±������ˮ�ⷴӦ��ǿ�������ᣬ�ó�C�Ľṹ��ʽ
������B��C������������±������ˮ�ⷴӦ��ǿ�������ᣬ�ó�C�Ľṹ��ʽ ��C��CH3COOH����������Ӧ���Ƴ�D�Ľṹ��ʽΪ
��C��CH3COOH����������Ӧ���Ƴ�D�Ľṹ��ʽΪ �����ø�����ص�ǿ�����ԣ�����CH3�����ɣ�COOH��E��NaOH��������ˮ�⣬��F�Ľṹ��ʽΪ
�����ø�����ص�ǿ�����ԣ�����CH3�����ɣ�COOH��E��NaOH��������ˮ�⣬��F�Ľṹ��ʽΪ ������F����G�ķ�Ӧ������Ӧ����ȡ����Ӧ�����룭NO2����G�Ľṹ��ʽΪ
������F����G�ķ�Ӧ������Ӧ����ȡ����Ӧ�����룭NO2����G�Ľṹ��ʽΪ ��Ȼ������ԭ��Ӧ���õ����
��Ȼ������ԭ��Ӧ���õ����
��1����������������AӦΪ�ױ���C�Ľṹ��ʽΪ ��C�к��й��������ǻ���
��C�к��й��������ǻ���
���Ǽױ����ǻ���
��2��C��D����������Ӧ������Ӧ����ʽΪ![]() +CH3COOH
+CH3COOH +H2O���÷�ӦΪ������Ӧ��ȡ����Ӧ��
+H2O���÷�ӦΪ������Ӧ��ȡ����Ӧ��
��Ϊ![]() +CH3COOH
+CH3COOH +H2O��������Ӧ��ȡ����Ӧ��
+H2O��������Ӧ��ȡ����Ӧ��
��3��G�Ľṹ��ʽ��![]() ��
��
��Ϊ![]() ��
��
��4�����ǻ����ױ�������������C��D��E��F������Ӧ��Ŀ���DZ������ǻ����ֹ���ǻ���������
��Ϊ�������ǻ����ֹ���ǻ���������
��5�����ڷ����廯��������б�����������������ȡ������ȡ����λ��Ϊ�ڼ�ԣ��ܷ���ˮ�⣬˵������������D�Ľṹ��ʽΪ ���ڼ�����֣�������������λ�ã���ȡ��������ǣ�CH3�ͣ�CH2��O��CHO���ڼ�����֣�����ǣ�CH3�ͣ�COOCH3(�ڼ������)������ǣ�CH2CH3�ͣ�OOCH(�ڼ������)����ȥD�Ľṹ��ʽ������11�ֽṹ����4�ֲ�ͬ��ѧ��������ԭ�ӣ�����Ч����4�֣�Ӧ���ڶԳƽṹ��������Dz�ͬ��ѧ������ԭ�ӵĸ�������˷��ϵ���
���ڼ�����֣�������������λ�ã���ȡ��������ǣ�CH3�ͣ�CH2��O��CHO���ڼ�����֣�����ǣ�CH3�ͣ�COOCH3(�ڼ������)������ǣ�CH2CH3�ͣ�OOCH(�ڼ������)����ȥD�Ľṹ��ʽ������11�ֽṹ����4�ֲ�ͬ��ѧ��������ԭ�ӣ�����Ч����4�֣�Ӧ���ڶԳƽṹ��������Dz�ͬ��ѧ������ԭ�ӵĸ�������˷��ϵ���![]() ��
��![]() ��
��
����11�� ![]() ��
��![]() ��
��
��6���������������ʱ������һ��ȡ��������ȡ����λ��������ڡ���λ�ϣ�������üױ���Ũ���ᡢŨ���ᷢ����Ӧ���ڼ�����λ�����룭NO2��Ȼ�����ø�����������ԣ�����CH3�����ɣ�COOH��Ȼ����Fe��HCl�����½���NO2��ԭ�ɣ�NH2����·��Ϊ![]() ��
��
��Ϊ![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȲΪ��Ҫԭ�Ͽ��Ժϳɾ�����ϩ���۱�ϩ����ȶ�����ͼ��ʾ���йغϳ�·��ͼ��
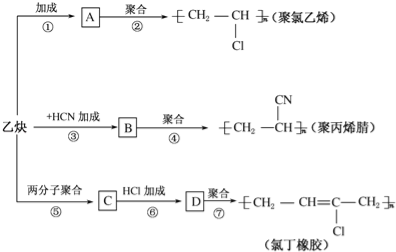
��֪��Ӧ��nCH2�TCH��CH�TCH2![]()
![]()
��������и��⣺
��1��д�����ʵĽṹ��ʽ��A ��C ��
��2��д����Ӧ�Ļ�ѧ����ʽ
��Ӧ���� ��
��Ӧ���� ��
��Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���![]() ���
���![]() ���
���![]() �����������ϡ��Һ
�����������ϡ��Һ![]() ��a��b��c��
��a��b��c��![]() ��
��![]() ��
��![]() ����д
����д![]()
![]() �������ʵ���Ũ����ͬʱ��
�������ʵ���Ũ����ͬʱ��![]() �ɴ�С��˳����____________��
�ɴ�С��˳����____________��
![]() ͬ���ͬ���ʵ���Ũ�ȵ������ᣬ�к�NaOH�����ɴ�С��˳����____________��
ͬ���ͬ���ʵ���Ũ�ȵ������ᣬ�к�NaOH�����ɴ�С��˳����____________��
![]() ����
����![]() ��ͬʱ�����ʵ���Ũ���ɴ�С��˳��Ϊ____________��
��ͬʱ�����ʵ���Ũ���ɴ�С��˳��Ϊ____________��
![]() ��
��![]() ��ͬ�������ͬʱ��ͬʱ������״���������ܶ���ͬ��п����������ͬ���������
��ͬ�������ͬʱ��ͬʱ������״���������ܶ���ͬ��п����������ͬ���������![]() ��ͬ״��
��ͬ״��![]() ����ʼʱ��Ӧ���ʵĴ�С��ϵ��____________��
����ʼʱ��Ӧ���ʵĴ�С��ϵ��____________��
![]() ��
��![]() ��ͬ�����������ˮϡ����ԭ����10����
��ͬ�����������ˮϡ����ԭ����10����![]() �ɴ�С��˳��Ϊ_____________��
�ɴ�С��˳��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ն�����ж��ص������������ϵ�������Ƭ֮һ���Ȼ��崼��Ӱ��������������֮һ���ṹ��ͼ��ʾ������˵����ȷ����
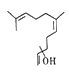
A. �����ʵĻ�ѧʽ��C15H26O
B. �����ʲ���ʹ���Ը��������Һ��ɫ
C. �����ʵ�ͬ���칹������Ƿ����廯����
D. �����ʿ��Է����ӳɷ�Ӧ�����ܷ�����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����������ӽ���Ĥ����Ĥ�Ʊ��ߴ��ȵ�Cu��װ��ʾ��ͼ�������й���������ȷ����
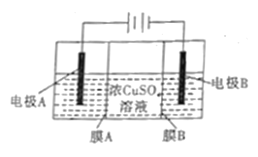
A. �缫A�Ǵ�ͭ���缫B�Ǵ�ͭ
B. ��·��ͨ��1mol���ӣ�����32gͭ
C. ��Һ��SO42-��缫AǨ��
D. ĤB�ǹ���Ĥ����ֹ�����༰���ʽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ���ʽ3Cu+8HNO3(ϡ)=3Cu(NO3)2+2NO��+4H2O���ش��������⣺
��1����˫���ŷ���ʾ���ӵ�ת�Ƶķ�����Ŀ_______��
��2���÷�Ӧ�е���������________������������________��
��3���÷�Ӧ��������Ũ�����������________��_______��
��4�������Ϊ���ӷ�Ӧ����ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�õ�ⷨ�ֿ���������Cr2O72-������NO2-�����Է�ˮ[����Cr2O72-ת��ΪCr3+��NO2-ת��Ϊ������]����װ����ͼ��ʾ��
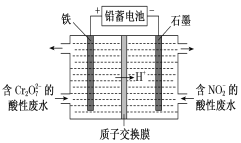
�������缫��Ӧ��________________________��
�����Cr2O72-ת��ΪCr3�������ӷ���ʽ��_________________________________________��
�ڵ�����������2 mol NO2-ʱ���ҳؼ��ٵ�H�������ʵ���Ϊ________ mol��
���������缫����ʯī���������缫��ӦʽΪ��_________________________________��
(2)�ɼ״�(CH3OH)��������NaOH��Һ���ɵ������ֻ���أ���ʹ�ֻ�����ʹ��һ���²ų�һ�ε硣
�ٸõ�ظ����ĵ缫��ӦʽΪ___________________________________________�������缫��Ӧʽ_____________________________________________��
�����Ըõ��Ϊ��Դ����ʯī���缫���200 mL����2mol��L��1HCl��0.5mol��L��1CuSO4�Ļ����Һ���������ռ�����ͬ���(��ͬ������)������ʱ(������Һ����ı仯���缫������ܴ��ڵ��ܽ�����)���������ռ�������������Ϊ_____g���ܹ�ת��_____mol���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ[(CH3COO)2Cu��H2O]�������ʽ��Ϊ200��������������ѧ�ķ����Լ����������л��ϳɴ������������ϵȡ������ü�ʽ̼��ͭ������������Ʊ���
ʵ�鲽�裺
(I)��ʽ̼��ͭ���Ʊ�

(��)����ͭ���Ʊ�
��ʽ̼��ͭ����ᷴӦ�Ƶô���ͭ��
Cu(OH)2��CuCO3+4CH3COOH=2(CH3COO)2Cu��H2O+CO2��+H2O
����Ʒ��ʽ̼��ͭ�����ձ��ڣ�����Լ20mL����ˮ�����Ƚ�����323K���ң���μ����������������岻���ܽ⣬���ȹ��ˡ���Һ��ͨ�����������ԭ�����![]() ���ң���ȴ�����£���ѹ���ˣ�����������ˮϴ�ӣ���(CH3COO)2Cu��H2O��Ʒ��������������ʡ�
���ң���ȴ�����£���ѹ���ˣ�����������ˮϴ�ӣ���(CH3COO)2Cu��H2O��Ʒ��������������ʡ�
�ش��������⣺
(1)����(��)����ĥ������ע����ˮ�з�Ӧ��д�����ӷ�Ӧ����ʽ______��
(2)��ʽ̼��ͭ���Ʊ�������ˮ�н��з�Ӧ�����¶��������60�����ң������ԭ��______��
(3)�ڲ���(��)�벽��(��)��ʵ������У��漰���ֹ�Һ����ķ������ֱ������������ˡ����ȹ������ѹ���ˣ�����װ����û��ʹ�õ�����______��
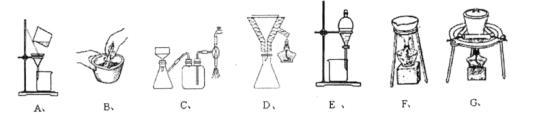
(4)��������ϴ�Ӿ���ľ��������______��
(5)���ճ������õIJ�ƷΪ8.0g�������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���о���������������ʱ���ı��ܱ�������ijһ������A2(g)+3B2(g) ![]() 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ������(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�������жϲ���ȷ���ǣ� ��
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ������(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�������жϲ���ȷ���ǣ� ��
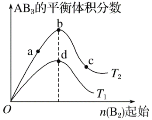
A. ��T2<T1��������Ӧһ���Ƿ��ȷ�Ӧ
B. ��T2��n(A2)����ʱ�ﵽƽ�⣬AB3�����ʵ�����СΪc��b��a
C. �ﵽƽ��ʱA2��ת���ʴ�СΪb>a>c
D. ��T2<T1���ﵽƽ��ʱb��d��ķ�Ӧ����Ϊvd��vb
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com