
【题目】随着科技的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mg NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。请回答下列问题:
①步骤(1)中A仪器最好用__________(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
②能否用水代替苯_______,理由是______________________。
③NaCl晶体中,Na+和Cl-是按一定方式有规则均匀排列的,可以看作一系列立方体在空间的延伸。已知立方体的边长为acm,它拥有b个钠离子和b个氯离子,用上述测定方法测得的阿伏加德罗常数NA的表达式为__________。
科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示);A与C形成CA3型分子,分子中C原子的杂化类型为 , 分子的立体结构为;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式; A2D由液态形成晶体时密度(填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA , 则该晶体的密度为g/cm3(用含a、NA的符号表示). 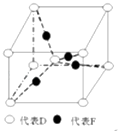
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): 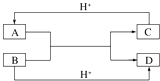
①如果A、B、C、D均是10电子的粒子,请写出:A电子式:;D的结构式: .
②如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:A与B在溶液中反应的离子方程式为 . 根据上述离子方程式,可以判断C与B结合质子的能力大小是 . (用化学式或离子符号表示).
(2)另一10电子物质,相同条件下对H2的相对密度为8,常温常压下,3.2g该物质与足量氧气充分燃烧后放出akJ热量,(a>0).写出该物质燃烧热的热化学方程式: .
将3.2g该物质燃烧后的产物通入100mL3molL﹣1的NaOH溶液中,充分反应后所得的溶液中离子浓度大小关系为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是( )
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素间只能形成共价键
D.金属元素与非金属元素的原子间只能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程: 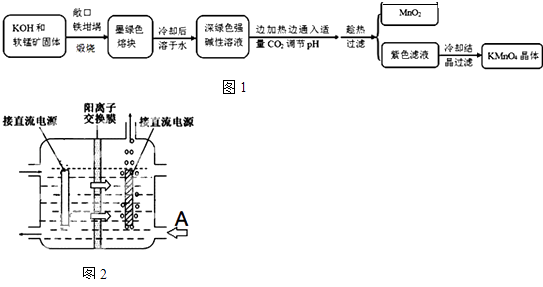
相关资料:
①物质溶解度
物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42﹣)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42﹣会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是;
(2)实验时,若CO2过量会生成KHCO3 , 导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:;
其中氧化还原反应中氧化剂和还原剂的质量比为 .
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中 , 得到的产品纯度更高.
A.醋酸
B.浓盐酸
C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为 . 使用阳离子交换膜可以提高Mn元素利用率的原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 NH4+、 Mg2+、 Ba2+、 Cl-、 SO42—、 CO32—。
将该混合物溶于水后得澄清溶液。 现取3份100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
A | 加 AgNO3溶液 | 有白色沉淀生成 |
B | 加足量 NaOH 溶液并加热 | 收集到气体 1.12 L(标准状况下) |
C | 加足量 BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥称量 | 第一次称量沉淀质量为6.63 g,第二次称量沉淀质量为4.66 g |
试回答下列问题:
(1)根据实验A判断 Cl-是否存在_____(填“一定存在” 、 “一定不存在” 或“不能确定”)。
(2)该混合物中一定不存在的离子是_____。
(3)写出实验B发生反应的离子方程式_____________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
(5)混合物中是否存在 K+?_____(填“存在” 或“不存在” )
①如果存在, c(K+) _____mol/L(如果选择“不存在” ,此问不必做答)
②如果不存在,判断的理由是_____。(如果选择“存在” ,此问不必做答)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com