
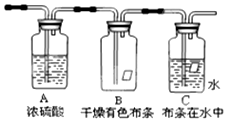
 某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答:
某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答:分析 实验室在加热条件下,用浓盐酸和二氧化锰发生氧化还原反应生成氯气,反应的化学方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,浓硫酸具有吸水性,A可用于干燥氯气,B、C用于比较氯气是否具有漂白性,氯气可与水反应生成具有漂白性的次氯酸,干燥的氯气不具有漂白性,以此解答该题.
解答 解:(1)浓盐酸和二氧化锰发生氧化还原反应生成氯气,反应的化学方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,本实验为对比实验,将氯气分别作用于干燥布条和湿润布条进行比较,不难看出实验目的是探究氯气具有漂白性的条件,浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体中的水的作用,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;探究氯气具有漂白性的条件;干燥氯气;
(2)干燥氯气不具有漂白性,所以B中有色布条不能褪色,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,所以C中有色布条褪色,
故答案为:有色布条不褪色;有色布条褪色;
(3)氯水溶液中存在反应:Cl2+H2O?HCl+HClO,是可逆反应,存在电离:H2O?H++OH-、HClO?H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-.
氯水呈黄绿色,起作用的是Cl2;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子,
故答案为:Cl2;HClO.
点评 本题考查氯气的制备以及性质实验的设计,为高考常见题型和高频考点,题目难度中等,试题侧重对学生基础知识的训练和检验,有利于培养学生的实验能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | HCl(aq)$\stackrel{MnO_{2}}{→}$Cl2$\stackrel{澄清石灰水}{→}$Ca(ClO)2 | |
| C. | N2$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{O_{2}、H_{2}O}{→}$HNO3 | |
| D. | 饱和NaCl溶液$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60s内反应速率为v(X)=0.05mol/(L•s) | |
| B. | 其它条件不变,升高温度,正反应速率增大,逆反应速率减小 | |
| C. | 其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | |
| D. | 其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 氨气可以完成喷泉实验,说明氨气极易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
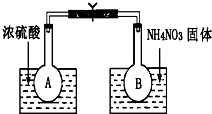 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
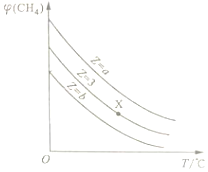 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时φ (CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时φ (CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为a>3>b | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是制造光导纤维的材料 | |
| B. | 二氧化硅是制造光电池常用材料 | |
| C. | 陶瓷含有的主要成分是硅酸盐 | |
| D. | 水泥、沙子、水玻璃的成分是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | Ba(OH)2溶液与稀硫酸 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Fe和稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-b kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| D. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-2b kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com