
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
|
|
| 5 |
|
|
| 5 | ||
|
| 7 | ||
|
| 7 |
A.上述正极反应均为![]()
B.在不同溶液中,![]() 是影响吸氧腐蚀速率的主要因素
是影响吸氧腐蚀速率的主要因素
C.向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快
固体,吸氧腐蚀速率加快
D.![]() 内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
【答案】B
【解析】
根据所给的信息可知,![]() 溶液中阳离子是
溶液中阳离子是![]() ,且
,且![]() 浓度相同,均为
浓度相同,均为![]() ,而阴离子不同;
,而阴离子不同;![]() 溶液中的阳离子是
溶液中的阳离子是![]() ,且
,且![]() 浓度相同,均为
浓度相同,均为![]() ,而阴离子不同,根据图象可知,
,而阴离子不同,根据图象可知,![]() 的反应速率接近,
的反应速率接近,![]() 的反应速率接近,且
的反应速率接近,且![]() 远大于
远大于![]() ,
,![]() 远大于
远大于![]() ,故阴离子对反应速率影响不大,是阳离子影响了反应速率,据此分析解答。
,故阴离子对反应速率影响不大,是阳离子影响了反应速率,据此分析解答。
A. 根据图象可知,实验装置中的氧气浓度是逐渐降低的,故此腐蚀为吸氧腐蚀,故正极反应均为![]() ,故A正确;
,故A正确;
B. 根据图象可知,![]() 的反应速率接近,
的反应速率接近,![]() 的反应速率接近,且
的反应速率接近,且![]() 远大于
远大于![]() ,
,![]() 远大于
远大于![]() ,故阴离子对反应速率影响不大,
,故阴离子对反应速率影响不大,![]() 是影响反应速率的主要因素,故B错误;
是影响反应速率的主要因素,故B错误;
C.![]() 是影响反应速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,故向实验
是影响反应速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,故向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快,故C正确;
固体,吸氧腐蚀速率加快,故C正确;
D.![]() 溶液显酸性,
溶液显酸性,![]() 显中性,根据图象可知,铁钉的平均腐蚀速率酸性溶液大于中性溶液,故D正确;
显中性,根据图象可知,铁钉的平均腐蚀速率酸性溶液大于中性溶液,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 五种元素的原子序数依次增大,B、C 的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的氧化物既能与强酸反应,又能与强碱反应;D的原子结构示意图为: ;E的最外层电子数是电子层数的2倍。试回答下列各问题:
;E的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)B、D元素分别为_________、_________;
(2)D元素位于元素周期表中第_______周期、第______族;
(3)化合物B2A的电子式____________________;
(4)E的最高价氧化物的水化物的分子式是________________________。
(5)D与NaOH溶液反应的化学方程式:_______________________________。
(6)C的氧化物与E的最高价氧化物的水化物溶液反应的离子方程式: ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
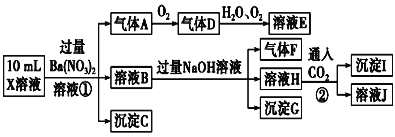
A.气体A是NO2
B.X溶液中肯定存在Fe2+、Al3+、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
![]()
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.  催化剂活性
催化剂活性![]()
B. 
![]()
![]() ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量![]() 和
和![]() ,正反应速率随时间变化
,正反应速率随时间变化
C. 
![]()
![]() ,t时刻改变某一条件,则
,t时刻改变某一条件,则![]()
D.  向等体积等pH的HCl和
向等体积等pH的HCl和![]() 中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:
①KCl ②CH4 ③NH4NO3 ④I2 ⑤Na2O2 ⑥HClO4 ⑦N2 ⑧CO ⑨SO2 ⑩金刚石 CH3CH2OH MgO MgCl2 KOH HCl Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
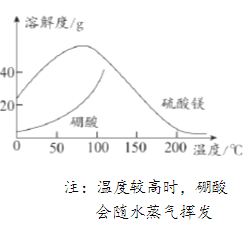
【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(1)上述流程中能加快反应速率的措施有______、_______等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______、______。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH- B(OH)4-。下列关于硼酸的说法正确的是__(填序号)。
a. 硼酸是一元酸
b. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c. 硼酸的电离方程式可表示为:H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,______(填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子: 用MgO调节溶液的pH至______以上,使杂质离子转化为______(填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,______(将方法补充完整)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)盛装0.2000 mol/L盐酸标准液应该用__式滴定管。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__;终点判断方法:_________________
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:_____
(4)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20. 00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为______mol/L(保留四位有效数字)
(5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则会使所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com