
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{18}$O为不同的核素,有不同的化学性质 | |
| B. | H2、SO2、NH3三种气体都可用浓硫酸干燥 | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| D. | 陶瓷、玻璃、水泥、大理石的主要成分都是硅酸盐 |
分析 A.同位素的化学性质是相似的;
B.浓硫酸具有强氧化性、酸性和吸水性,可用来干燥酸性、中性并不与浓硫酸发生氧化还原反应的气体;
C.根据溶液中分散质微粒直径小于1nm,胶体分散质微粒直径介于1~100nm之间,浊液分散质微粒直径大于100nm;
D.玻璃、陶瓷和水泥是常用的硅酸盐产品.
解答 解:A.同位素是同种元素的不同原子,它们的化学性质是相似的,故A错误;
B.NH3与浓硫酸反应生成硫酸铵,不能用浓硫酸干燥,故B错误;
C.因溶液中分散质微粒直径小于1nm,胶体分散质微粒直径介于1~100nm之间,浊液分散质微粒直径大于100nm,所以分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故C正确;
D.大理石的主要成分是碳酸钙,故D错误.
故选C.
点评 本题考查核素、浓硫酸作为干燥剂的性质分散系以及物质的成分等,题目难度不大,注意与浓硫酸反应的气体不能用浓硫酸干燥.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/LNaHSO4与0.5mol/LBa(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2mol/LFe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20mL0.5mol/LFeBr2(aq)中通入224mLCl2(标况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30mL0.5mol/LNaOH(aq)中通入224mLCO2(标况):3OH-+2CO2═CO32-+HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用渗析的方法除去淀粉中的氯离子 | |
| C. | 用结晶的方法分离氯化钠和硝酸钾 | |
| D. | 用分液的方法除去四氯化碳中混有的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
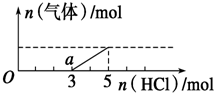 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 常温下,a点溶液pH>7 | |
| C. | 标准状况下,通入CO2的体积为4.48L | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | ①③⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 水解反应 | ||
| C. | 醋酸的电离 | D. | 盐酸与NaOH溶液的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com