
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体__________g。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验。
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1): 。
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:已知:反应后混合溶液的比热容c=4.2×10—3 kJ/(g·℃)
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ℃ |
2 | 25.9 | 25.9 | 25.9 | 29.8 | |
3 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算中和热 kJ·mol-1(小数点后保留两位数字)。
③能引起中和热偏高的原因是 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:填空题
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能” 或“不能”) 大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
③ 已知在25℃时,CO32-水解反应的平衡常数Kh= =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体, c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后Mg(OH)2不可能转化为MgF2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:选择题
可逆反应:2AB3(g) A2(g)+3B2(g);ΔH﹥0,下列图像正确的是
A2(g)+3B2(g);ΔH﹥0,下列图像正确的是
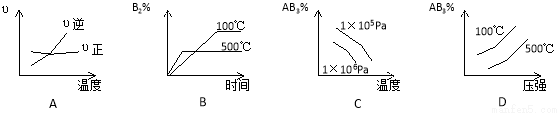
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:选择题
在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的平衡浓度分别为0.1 mol/L、
2Z(g),已知X2、Y2、Z的平衡浓度分别为0.1 mol/L、
0.3 mol/L、0.2 mol/L,各物质的起始不可能是
A.Z为0.3 mol/L B.Y2为0.1 mol/L
C.X2为0.2 mol/L D.Z为0.35mol/L
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:选择题
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是
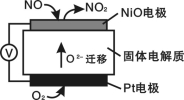
A.该装置实现化学能向电能的转化
B.该电池的总反应为2NO + O2 = 2NO2
C.NiO电极的电极反应式: NO + O2- - 2e— = NO2
D.当有2.24L的O2参与反应时,转移了0.4mole—
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省福安市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是
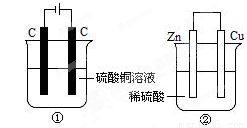
A.产生气体体积①=②
B.电极上析出固体质量①<②
C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑②中负极2H++2e-=H2↑
D.溶液的pH变化:①减小②增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com