
| A、1mol羧基中含有的电子数为23NA |
| B、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA |
| C、1mol OH-中含有的电子数为为9NA |
| D、标准状况下,22.4L苯含有的分子数为0.1NA |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、1mol 甲烷中含有8nA个电子 |
| B、在铜与硫的反应中,1 mol铜失去的电子数为2nA |
| C、标准状况下,11.2L CCl4中含有2nA个Cl原子 |
| D、20 g D2O(重水)中含有10nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、4NH3+5O2
| ||||
B、2H2+O2
| ||||
| C、CaCO3+2HCl═CaCl2+CO2↑+H2O | ||||
| D、KOH+HCl═KCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
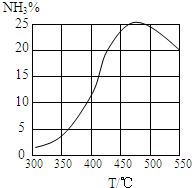 向恒压密闭容器中,通入物质的量比为1:3的氮气与氢气的混合气体,在催化剂作用下,控制不同温度进行合成氨实验.在经过相同时间后,测得不同温度下的氨气的体积分数如图.下列说法不正确的是( )
向恒压密闭容器中,通入物质的量比为1:3的氮气与氢气的混合气体,在催化剂作用下,控制不同温度进行合成氨实验.在经过相同时间后,测得不同温度下的氨气的体积分数如图.下列说法不正确的是( )| A、通过该图能判断合成氨反应的△H<0 |
| B、450℃之前的曲线上的任意点都没有达到平衡状态 |
| C、曲线最高点对应的温度下反应速率最快 |
| D、升温,该反应的平衡常数K呈下降趋势 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前5min内用X的浓度变化表示的平均反应速率为0.5 mol?(L?min)-1 |
| B、5min末时Y的浓度为 2mol?L-1 |
| C、化学方程式中n=3 |
| D、5min末时W的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol??L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com