

分析 单质A与氯气反应生成棕黄色的烟,且溶于水变为蓝色溶液,可知A为Cu,B为CuCl2,C为CuCl2的溶液,蓝色沉淀D为Cu(OH)2,黑色固体E为CuO,结合对应物质的性质以及题目要求解答该题.
解答 解:单质A与氯气反应生成棕黄色的烟,且溶于水变为蓝色溶液,可知A为Cu,B为CuCl2,C为CuCl2的溶液,蓝色沉淀D为Cu(OH)2,黑色固体E为CuO,
(1)由以上分析可知A为Cu,B为CuCl2,E为CuO,故答案为:Cu;CuCl2;CuO;
(2)氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,反应的化学方程式为CuCl2+2NaOH=Cu(OH)2↓+2NaCl,
CuO和氢气在加热条件下反应生成铜和水,方程式为CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,
故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握物质的性质以及转化的现象,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯在银作催化剂的条件下与氧气反应生成环氧乙烷 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 乙烯与氯化氢加成制氯乙烷 | |
| D. | 利用乙烯与氢气加成制得的乙烷与氯气在光照条件下制氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
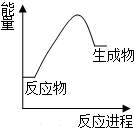
| A. | 生成物比反应物稳定 | |
| B. | 该反应的△H<0 | |
| C. | 该图可以表示石灰石高温分解反应 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
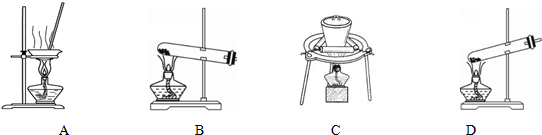
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液, 振荡,观察; | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸 再加入少许AgNO3溶液振荡,观察. | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 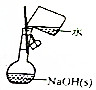 配制0.10mol•L-1的NaOH溶液 配制0.10mol•L-1的NaOH溶液 | |
| B. | 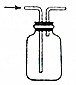 在实验室中用排空气法收集CO2 在实验室中用排空气法收集CO2 | |
| C. | 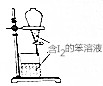 用苯萃取碘水中的碘,分出水层后的操作 用苯萃取碘水中的碘,分出水层后的操作 | |
| D. | 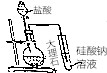 比较Cl,C,Si三种元素的非金属性强弱 比较Cl,C,Si三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
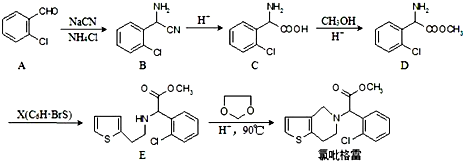
 ,
, ;
;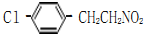 、
、 、
、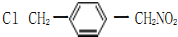
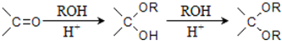
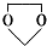 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
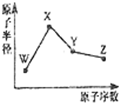 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 对应简单离子半径:W>X | |
| B. | 对应气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW既含离子键,又含极性共价键 | |
| D. | Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com