
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
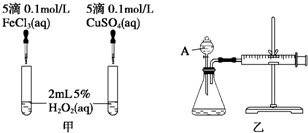
分析 (1)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气;
(2)比较两个实验知,这两个实验只有催化剂表面积不同其它因素完全相同,导致两个实验中化学反应速率不同;
(3)探究Fe3+和Cu2+对H2O2分解的催化效果,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰;
(4)该仪器是分液漏斗,催化效率越高,则一定时间内产生的气体越多.
解答 解:(1)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)比较两个实验知,这两个实验只有催化剂表面积不同其它因素完全相同,导致两个实验中化学反应速率不同,所以影响催化效果的是催化剂的颗粒大小,故答案为:催化剂的颗粒大小;
(3)在探究Fe3+和Cu2+对H2O2分解的催化效果是,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰,
故答案为:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;
(4)由图可知,A为分液漏斗.定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生40mL的气体所需的时间来比较.产生40mL的气体所需的时间越短,则催化效果越好,
故答案为:分液漏斗;收集40 mL气体所需要的时间.
点评 本题考查探究影响化学反应速率因素,侧重考查学生实验操作及实验分析、归纳总结能力,探究化学反应速率影响因素时必须只有一个因素不同其它因素必须完全相同,否则无法得出正确结论,如(3)将FeCl3改为Fe2(SO4)3更为合理,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
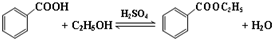
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

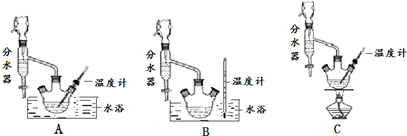
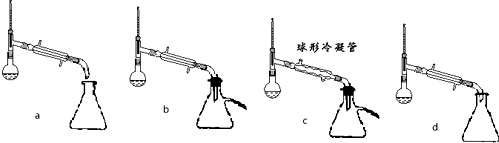
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 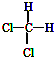 是两种种不同的物质 是两种种不同的物质 | |
| B. | 由乙烯之间的相互加成可以得到聚乙烯 | |
| C. | 丁烷与丁烯互为同系物 | |
| D. | 乙酸不能使紫色石蕊变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com