
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为![]() ,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B________,C________,D________。
(2)D元素在周期表中属第________周期第________族。
(3)用电子式表示A的气态氢化物的形成过程:_____________________。
(4)A和B的单质充分反应生成化合物的结构式是____________________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?___________________________。
【答案】(1)碳;氧;镁;铝
(2)第三周期第ⅢA族
(3)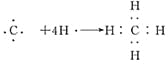
(4)O=C=O。
(5)B与C形成的化合物是MgO,为离子化合物;
证明方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物。
【解析】试题分析:B原子L层的电子总数是K层的3倍,则B为氧元素;A和B在同一周期,A的电子式为![]() ,则A为碳元素;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),则C为+2价金属,又由于A、B、C、D的原子序数依次增大且均小于18,可得C为镁元素;D离子的半径比C离子的小,D离子与B离子的电子层结构相同,则D为铝元素。
,则A为碳元素;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),则C为+2价金属,又由于A、B、C、D的原子序数依次增大且均小于18,可得C为镁元素;D离子的半径比C离子的小,D离子与B离子的电子层结构相同,则D为铝元素。
(1)综上所述,A、B、C、D元素的名称分别为碳、氧、镁、铝。
(2)D为铝元素,位于周期表中第三周期第ⅢA族。
(3)A的气态氢化物为CH4,用电子式表示其形成过程为: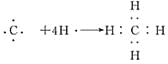 。
。
(4)A和B的单质充分反应生成化合物为CO2,结构式为O=C=O。
(5)B与C形成的化合物是MgO,为离子化合物;证明方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物。


科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准 KMnO4 溶液滴定未知浓度的 FeSO4,下列说法或操作正确的是
A.盛 FeSO4溶液的锥形瓶滴定前用 FeSO4溶液润洗 2—3 次
B.选碱式滴定管盛放标准 KMnO4溶液,并用碘化钾淀粉溶液作指示剂
C.滴定前仰视读数,滴定后俯视读数会导致滴定结果偏低
D.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
(1)新鲜的瓜果蔬菜窗含_____________,多吃可以预防____________病。下列富含该成分____________的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
(2)某品牌食品调料标签的一部分如图。

①配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生______反应得到。
②小麦粉中的主要营养物质是_________。
③配料中,属于着色剂的是 ;厲于甜味剂的是__________;厲于防腐剂的是___________;
④人体内有8种氨基酸必需通过食物摄入才能获取,这8种产品氨基酸成为_______氨基酸。
(3)①维生素A又称________维生素(填字母)。
A.视黄醇,水溶性 B.抗坏血酸,水溶性 C.视黄醇,脂溶性
②下列药物中属于抗生素的是___________(填字母)。
A.复方氢氧化铝片 B.阿司匹林 C.青霉素
③ 加碘盐中碘元素的存在形式是__________(填字母)
a.I2 b.KIO3 c.KI
④在食品加工或餐饮业中,特别要严加控制用量的物质是_________(填字母)。
A.亚硝酸钠 B.碳酸氢钠 C.氯化钠
⑤综合利用“地沟油”的一种方法是将它水解以获取高级脂肪酸和__________(填名称)。
⑥使用靑霉素可能会产生过敏,在用药前患者一定要进行______________。
⑦抗酸药可治疗胃酸过多的原因是这类药物中含有的一种或几种化学物质,Al(OH)3是抗酸药的一种,请写出其与胃酸反应的离子方程式________________。
⑧靑霉素属于 (选填“处方药”或“非处方药”),通常外包装盒上标有________(选填“OTC”或“R”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100 mL的NaOH和Ba(OH)2混合碱溶液分成两等份,一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33 g;另一份加入50 mL0.1 mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3 mol/L(此时溶液的体积为100 mL),试计算:
(1)原混合碱溶液中所含Ba(OH)2的物质的量是________。
(2)原混合溶液中NaOH的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=11的X、Y两种碱溶液,分别从1 mL稀释至100 mL,其pH与溶液体积(V)的变化关系如图,下列说法正确的是
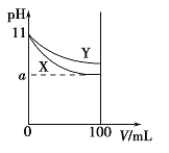
A.稀释前,X、Y中溶质碱的物质的量浓度相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.同浓度盐酸分别与X、Y这两种碱溶液恰好完全反应时,消耗盐酸的体积V(X)>V(Y)
D.若a>9,则X和Y都为弱碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________周期第________族。
(2)E元素形成的氧化物对应的水化物的化学式为________________________。
(3)元素C、D、E形成的简单离子半径大小关系是______>________>________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________。C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________。
(5)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com