
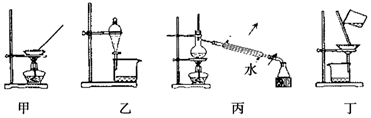
| A. | 甲装置可用于从氯化钠溶液中提取氯化钠 | |
| B. | 乙装置可用于分离溴单质与四氯化碳 | |
| C. | 丙装置可用于蒸馏,分离I2和水 | |
| D. | 丁装置可用于过滤,分离汽油和水的混合物 |
分析 A.NaCl溶于水,可利用蒸发分离;
B.溴单质与四氯化碳不分层;
C.I2和水的混合物,应选萃取、蒸馏分离;
D.汽油和水的混合物分层.
解答 解:A.NaCl溶于水,可利用蒸发分离,可利用图中蒸发装置分离,故A正确;
B.溴单质与四氯化碳不分层,应选蒸馏法分离,不能利用图中分液装置分离,故B错误;
C.I2和水的混合物,应选萃取、蒸馏分离,不能直接蒸馏,故C错误;
D.汽油和水的混合物分层,可分液分离,不能利用图中过滤分离,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量时,左盘低,右盘高 | B. | 定容时俯视读取刻度 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 定容时液面超过了刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+Na2SO4═BaSO4↓+2NaOH | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
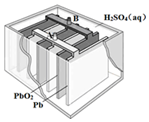 铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:| A. | 放电时,电解质溶液的PH值增大 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g | |
| C. | 放电时,溶液中H+向PbO2电极移动 | |
| D. | 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
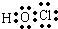 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 | B. | 15 | C. | 13 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com