
 电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O+Zn+H2O═2Ag+Zn(OH)2,示意图如图.下列判断正确的是( )
电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O+Zn+H2O═2Ag+Zn(OH)2,示意图如图.下列判断正确的是( )| A. | 锌为负极,被还原 | |
| B. | 纽扣电池工作时,OHˉ移向Ag2O | |
| C. | 每6.5 g 锌发生反应时,转移电子0.1 NA | |
| D. | 纽扣电池工作时,电解质溶液的碱性增强 |
分析 根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,则正极为Ag2O,得电子发生还原反应;从总反应方程式分析,氢氧根离子的物质的量没变化但溶剂的量减少,所以碱性增大;电池工作时由电荷守恒可知,带负电荷的阴离子应该移向负极,带正电荷的离子移向正极.
解答 解:A、根据化合价变化可知Zn被氧化,应为原电池的负极,被氧化,故A错误;
B、根据化合价变化可知Zn被氧化,应为原电池的负极,带负电荷的阴离子应该移向负极,所以OHˉ移向Zn,故B错误;
C、原电池工作时,负发生反应Zn+2OH--2e-=ZnO+H2O,则每6.5 g 锌发生反应时,转移电子0.2 NA,故C错误;
D、从总反应方程式分析,氢氧根离子的物质的量没变化但溶剂的量减少,所以碱性增强,故D正确.
故选D.
点评 本题考查原电池知识,题目难度不大,注意电极反应式的应用.


科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:Al+3OH-═Al(OH)3↓ | |
| B. | 金属钠投入到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | FeCl2溶液中滴加氨水:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 碳酸钡与稀盐酸反应:BaCO3+2H+═Ba2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
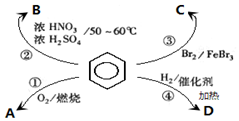
| A. | 反应①为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| B. | 反应②为取代反应,有机产物B是一种芳香烃 | |
| C. | 反应③为取代反应,产物溴苯是比水重的无色液体 | |
| D. | 反应④为加成反应,若H2足量则产物D为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ | |
| B. | Y的起始浓度不能为零,平衡浓度也不能为零 | |
| C. | 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动 | |
| D. | 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Z2X是Cu2S、Z2Y是Cu2O | |
| B. | 步骤①发生的反应,其离子方程式可能为Cu2S+12H++10NO3ˉ=2Cu2++10NO2↑+SO42ˉ+6H2O | |
| C. | 步骤②发生的反应,其离子方程式为H++OHˉ=H2O、Cu2++2OHˉ=Cu(OH)2↓ | |
| D. | 步骤③发生的反应,说明葡萄糖具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3$\stackrel{HCI(ap)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | 饱和NaCl(aq) $\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(ap)}{→}$NaAlO2(aq) $\stackrel{过量HCI}{→}$Al(OH)3 | |
| D. | 海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{HCI(ap)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2(HCl)用NaOH溶液 | B. | Na2CO3(NaHCO3)用HCl溶液 | ||
| C. | NaCl溶液(I2)用CCl4 | D. | FeCl2(FeCl3)通入Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com