

分析 根据流程图知,重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)、氮气和水,然后洗涤、烘干得到Cr2O3,在加热条件下,在反应器中发生反应Cr2O3+3CCl4═2CrCl3+3COCl2,三氯化铬易升华,在高温下能被氧气氧化,为防止三氯化铬被氧化,通入氮气,且充入的氮气能使反应物进入管式炉中进行反应;最后得到无水三氯化铬;
(1)重铬酸铵分解不完全,还可能含有其它可溶性杂质;因为(NH4)2Cr2O7显桔红色,所以可以提供颜色来判断;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量;
(3)氮气不能氧化三氯化铬且充入氮气能使反应物进入管式炉中进行反应;
(4)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色;滴入最后一滴时,如果溶液颜色在半分钟内不变色,则达到滴定终点;
若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果偏低;
②溶液中有溶解的氧气,氧气可以氧化I-氧化;
③Cr2O72-和I-发生氧化还原生成碘单质和铬离子;
④由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算.
解答 解:根据流程图知,重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)、氮气和水,然后洗涤、烘干得到Cr2O3,在加热条件下,在反应器中发生反应Cr2O3+3CCl4═2CrCl3+3COCl2,三氯化铬易升华,在高温下能被氧气氧化,为防止三氯化铬被氧化,通入氮气,且充入的氮气能使反应物进入管式炉中进行反应;最后得到无水三氯化铬;
(1)因为(NH4)2Cr2O7显桔红色,最后一次洗涤的流出液呈无色,说明洗涤干净,
故答案为:最后一次洗涤的流出液呈无色;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度,
故答案为:水浴加热(并用温度计指示温度);
(3)氮气不能氧化三氯化铬且充入氮气能使反应物进入管式炉中进行反应,为防止三氯化铬被氧化且使反应物进入管式炉中进行反应,充入氮气,
故答案为:赶尽反应装置中的氧气;鼓气使反应物进入管式炉中进行反应;
(4)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,所以可以用淀粉作指示剂;滴入最后一滴时,如果溶液颜色在半分钟内不变色,则达到滴定终点;
若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬反应不完全,所以导致它的质量分数的测量结果偏低;
故答案为:淀粉;最后一滴滴入时,蓝色恰好完全褪去,且半分钟内不恢复原色;偏低;
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差,
故答案为:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差;
③Cr2O72-和I-发生氧化还原生成碘单质和铬离子,离子方程式为:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,
故答案为:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
④设25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式:2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+) 0.0250mol/L×0.021L
故n(Cr3+)=0.0250mol/L×0.021L×$\frac{1}{3}$=0.000175mol,所以250mL溶液中n′(Cr3+)=0.000175mol×$\frac{250ml}{25ml}$=0.00175mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.00175mol,所以样品中m(CrCl3)=0.00175mol×158.5g/mol=0.2774g,故样品中无水三氯化铬的质量分数为:$\frac{0.2774g}{0.3000g}$×100%=92.5%,
故答案为:92.5%.
点评 本题考查学生对的实验方案原理的理解与评价、物质组成含量的测定、滴定应用、化学计算等,题目难度较大,明确实验原理为解答关键,难点是(4)题计算,易错点是基本实验操作,试题主要考察学生的实验设计能力和计算能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①④⑤ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
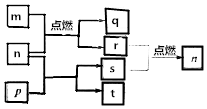 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: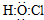 | |
| C. | 氮原子的结构示意图: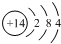 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
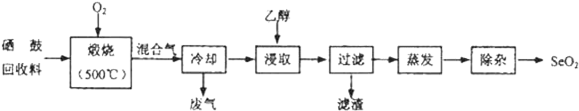
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

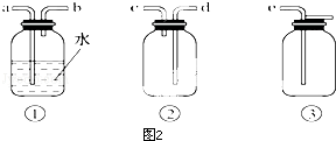
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com