
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| D. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
分析 A.应生成液态水;
B.能量越高越不稳定;
C.都为放热反应,放出的热量越多,则反应热越小;
D.从中和热的定义来判断,中和热的热化学方程式必须让生成的水为1mol.
解答 解:A.燃烧热指的是生成稳定的氧化物,应生成液态水,故A错误;
B.石墨转化为金刚石吸热,则石墨能量较低,石墨较稳定,故B错误;
C.都为放热反应,放出的热量越多,则反应热越小,故C错误;
D.在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热中和热.20.0gNaOH的物质的量n=$\frac{m}{M}$=$\frac{20g}{40g/mol}$=0.5mol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故D正确.
故选D.
点评 本题综合考查反应热与焓变,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关概念的理解,难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题

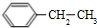 ;I
;I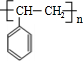 .
.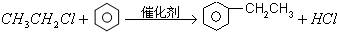 ;
;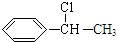 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$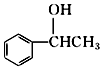 +NaCl;
+NaCl;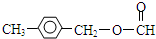 或
或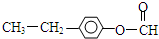 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
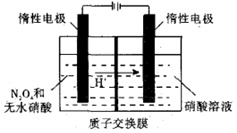 N2O5是绿色硝化试剂,溶于水可得硝酸.图是以N2O4为原料电解制备N2O5的装置示意图写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.
N2O5是绿色硝化试剂,溶于水可得硝酸.图是以N2O4为原料电解制备N2O5的装置示意图写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定状况下,N2的摩尔体积可能恰好为 11.2 L/mol | |
| B. | 在标准状况下 1 mol N2 的体积是 22.4 L/mol | |
| C. | 1 mol N2 的体积约是 22.4 L,则 N2 的温度和压强一定是标准状况 | |
| D. | 在标准状况下 H2O 的摩尔体积约是 22.4 L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3 | |
| B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | |
| C. | N2+3H2$?_{△}^{催化剂}$2NH3 | |
| D. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁铝矾有净水作用,其水溶液显中性 | |
| B. | 向该溶液中加入Na2S溶液,有淡黄色沉淀 | |
| C. | 用惰性电极电解该溶液时,阴极区有沉淀 | |
| D. | 在空气中,蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com