
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1CuSO4 溶液 | 将25.0gCuSO4•5H2O溶于蒸馏水配成100mL溶液 |
| B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 检验溶液是否含有SO42- | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
| D | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水的体积不等于溶液的体积;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离;
C.硝酸能将亚硫酸根氧化为硫酸根;
D.NH4+可与碱反应生成氨气.
解答 解:A.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故A正确;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离,故B正确;
C.硝酸有强氧化性,硝酸能将亚硫酸根氧化为硫酸根,故C错误;
D.NH4+可与碱反应生成氨气,氨气为碱性气体,可使红色湿润的石蕊试纸变蓝,故D正确.
故选C.
点评 本题考查化学实验方案的评价,涉及物质的分离、检验和溶液的配制等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的合理性和可行性的评价,难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 相同条件下,2molH2(g)与lmolO2(g)完全化合生成2molH2O(g),放出aKJ热量,2molH2 (g)与lmolO2(g)完全化合生成2molH2O(l),放出bkJ 热量,则a>b | |
| C. | 若CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 相同条件下,1molH2O(l)与1molCaO完全化合,放出a kJ热量,2molH2O(l)与2molCaO完全化合,也放出a kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
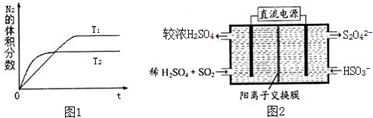
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
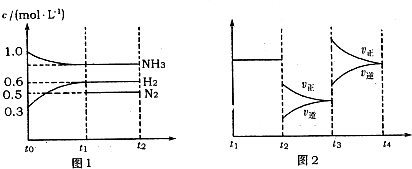
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
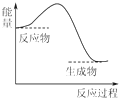
| A. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象和结论 | |
| A | 在平衡3KSCN+FeCl3?Fe(SCN)3+3KCl的溶液中加入少量KCl溶液 | 溶液红色变浅,平衡逆向移动 |
| B | 向AgI沉淀中滴入KCl溶液 | 有白色沉生成,Ksp(AgCl)<Ksp(AgI) |
| C | 把Cl2通入品红溶液中 | 溶液褪色,Cl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色,氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
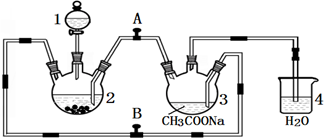
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
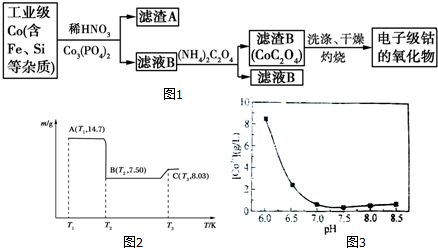
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com