
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
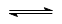 N2+CO2(2分)②c (2分)
N2+CO2(2分)②c (2分)  E↑ + F↑
E↑ + F↑ N2 +CO2
N2 +CO2

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH
CH3OH(g) ΔH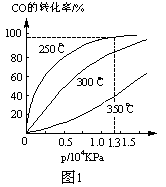
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
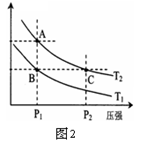
| A.铅蓄电池在放电过程中,正负极质量均增加 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释,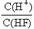 的值始终保持增大 的值始终保持增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol |
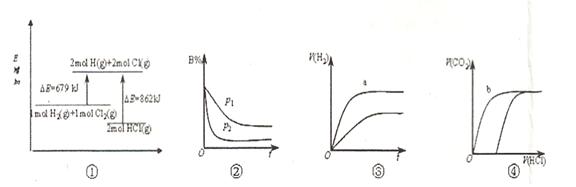
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.④表示10mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.lmol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
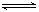 7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。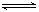 2SO3(g) ΔH =" —196.6" kJ·mol-1
2SO3(g) ΔH =" —196.6" kJ·mol-1 SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1 2NO2(g)的 ΔH =" _________" kJ·mol-1
2NO2(g)的 ΔH =" _________" kJ·mol-1 CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L—1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行 |
| B.铅蓄电池在放电过程中,溶液的PH值增加 |
| C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 |
| D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
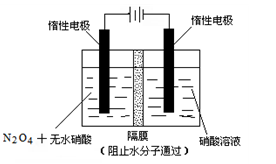
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)
CO(g) CH3OH(g)
CH3OH(g)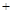 90.8 kJ
90.8 kJ CH3OCH3(g)
CH3OCH3(g)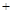 H2O(g)
H2O(g)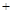 23.5 kJ
23.5 kJ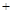 H2O(g)
H2O(g) CO2(g)
CO2(g)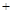 H2(g)
H2(g)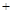 41.3 kJ
41.3 kJ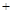 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g)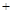 CO2(g)
CO2(g)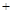 Q,其中Q
Q,其中Q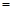 kJ;
kJ; CH3OCH3(g)
CH3OCH3(g)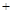 H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L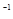 ) ) | 0.44 | 0.6 | 0.6 |
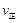 (甲醇)
(甲醇) 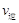 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。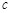 (CH3OH)
(CH3OH)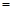 ;
;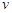 (CH3OH)
(CH3OH)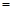 ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入醋酸钠 | B.加入ZnCl2 | C.加入铜粉 | D.加入硫酸铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com