

| ||
| ||
| 120”Įn”Į¦Ń”Įa% |
| 98”Į2”Įm |
| 120”Įn”Į¦Ń”Įa% |
| 98”Į2”Įm |


 æŚĖ抔דŌŖæŚĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
æŚĖ抔דŌŖæŚĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

| ||
| ||

t£Ømin£© ÅØ¶Č£Ømol/L£© |
0 | 1 | 2 | 3 | 4 | 5 | 6 |
| c£ØC£© | 0.054 | 0.034 | 0.018 | 0.012 | 0.008 | 0.006 | 0.006 |
| c£ØO2£© | 0.032 | 0.022 | 0.014 | 0.011 | 0.009 | 0.008 | 0.008 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
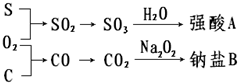 ĻĀĮŠĪļÖŹ¼äÓŠČēĶ¼ĖłŹ¾×Ŗ»Æ¹ŲĻµ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
ĻĀĮŠĪļÖŹ¼äÓŠČēĶ¼ĖłŹ¾×Ŗ»Æ¹ŲĻµ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ¹š×³ŗģʤŹé”¤øßÖŠĶ¬²½ĻµĮŠ”¤»īĢāĒɽāĒÉĮ·”¤ø߶ž»Æѧ£ØÉĻ£© ĢāŠĶ£ŗ022
ŗŚÉ«¹ĢĢåĪļÖŹAÓŠČēĶ¼ĖłŹ¾×Ŗ»Æ¹ŲĻµ£¬Ćæøö·½æņ±ķŹ¾ÓŠŅ»ÖÖ·“Ó¦Īļ»ņÉś³ÉĪļ(·“Ó¦Ģõ¼ž¼°Éś³ÉµÄĖ®ŅŃĀŌČ„)£¬ĘäÖŠC£¬F³£ĪĀĻĀĪŖĪŽÉ«ĘųĢ壬D£¬EÓŠ¹²Ķ¬µÄŃōĄė×Ó£®
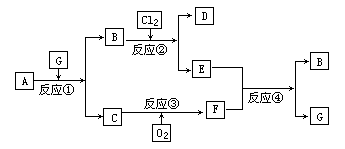
(1)Š“³öB£¬CµÄ»ÆѧŹ½£ŗB________£¬
””””””””””””””””””””””C________£®
(2)Š“³ö·“Ó¦¢ÜµÄĄė×Ó·½³ĢŹ½________£®
(3)Š“³ö·“Ó¦¢ŪµÄ»Æѧ·½³ĢŹ½£¬²¢±źĆ÷µē×Ó×ŖŅʵÄĒéæö________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗÄ£ÄāĢā ĢāŠĶ£ŗĶʶĻĢā

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com