
下列物质的使用不涉及化学变化的是
A.用饱和硫酸铵溶液沉淀蛋白质
B.用生石灰干燥氨气
C.用铝制的容器盛装浓硫酸
D.用饱和碳酸钠溶液收集实验室制取的乙酸乙酯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下列物质的存贮方法错误的是
A.金属钠保存在石蜡油或煤油中
B.用铁制或铝制容器运输浓硫酸、浓硝酸
C.FeCl2溶液的试剂瓶中要放铁钉
D.氢氧化钠溶液盛装在玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:实验题
(18分)化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
Ⅰ.下图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为下图B装置进行酯化反应效果比A要好,他的理由是_________________________;
某同学乙经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是 ________________________。

Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)碳与浓硝酸反应的方程式_______________________。甲同学的实验应该在___________中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是________________(用化学方程式表示),所以他认为应该检验_____________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_________。
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸。③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用_________(结合方程式与文字表述)。
(5)C装置中出现的现象是_________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 ________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
下列关于元素及其化合物的说法,正确的是
A.Fe在常温下可与浓硝酸,浓硫酸,稀硝酸发生剧烈反应
B.碳酸氢钠可用于制备纯碱,治疗胃酸过多的药物,食品发酵剂
C.通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体
D.根据某元素的质子数和中子数,可以确定该元素的相对原子质量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如下图所示。下列说法正确的是
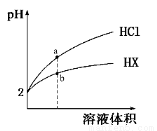
A.稀释前,c(HX)=0.01 mol/L B.稀释10倍,HX溶液的pH=3
C.a、b两点:c(X-)>c(Cl-) D.溶液的导电性:a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
下列物质的量浓度关系不正确的是
A.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3·H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>②
B.将0.1 mol·L-1的NaHS和0.1 mol·L-1Na2S溶液等体积混合:c(S2-)+2c(OH-)=2c(H+)+ c(HS-)+3c(H2S)
C.将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液:c(CH3COO-)+c(OH-)=0.10 mol·L-1
D.已知HClO+Na2CO3=NaClO+NaHCO3,在等物质的量浓度等体积次氯酸溶液与碳酸钠溶液混合溶液中:c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:实验题
(14分)硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下:

反应釜中发生反应:4NH4Cl+Mg2 Si 4NH3↑+SiH4↑+2MgCl2 △H<0
4NH3↑+SiH4↑+2MgCl2 △H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3 N4应属于 晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是 。
(2)上述生产硅烷的过程中反应釜抽真空的原因是 。
(3)液氨参与循环的作用是 。
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是 。
(5)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与胃酸反应的化学方程式是 。若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8·nH2O中n的值是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2 N2O5 (g) 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表

下列说法中不正确的是
A.T1温度下,500s时O2的浓度为0.74mol·L-1
B.平衡后其他条件不变。将容器的体积压缩到原来的l/2,则再平衡时c(N2O5)> 5.00mol·L-1
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2则K1<K2
D.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东肥城市高三一模理综化学试卷(解析版) 题型:选择题
下列实验操作错误的是
A.萃取、分液前需对分液漏斗检漏
B.制取硝基苯时,采取水浴加热,将温度计插入水浴液中
C.点燃甲烷、氢气、乙烯、CO等可燃性气体前必须验纯
D.液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com