
【题目】将一定量的铜粉加入到100 mL某浓度的稀硝酸中充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体224 mL(标准状况),然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2 g, 则(m1-m2)为
A.5.76B.2.88C.1.92D.0.28
【答案】B
【解析】
铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,反应生成Cu(NO3)2和NO气体,NO的物质的量为n(NO)=0.224L÷22.4L/mol=0.01mol,根据电子转移守恒可知,参加反应的铜的物质的量为0.01mol×(52)÷2=0.015mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.015mol,溶液中n(![]() )=0.03mol。再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中
)=0.03mol。再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中![]() 发生反应3Cu+8H++2
发生反应3Cu+8H++2![]() =3Cu2++2NO↑+4H2O,容器剩有铜粉m2 g,(m1-m2)为再与溶液中
=3Cu2++2NO↑+4H2O,容器剩有铜粉m2 g,(m1-m2)为再与溶液中![]() 反应的铜的质量,则由反应3Cu+8H++2
反应的铜的质量,则由反应3Cu+8H++2![]() =3Cu2++2NO↑+4H2O可知0.03mol
=3Cu2++2NO↑+4H2O可知0.03mol ![]() 再发生反应消耗Cu的物质的量是n(Cu)=
再发生反应消耗Cu的物质的量是n(Cu)=![]() ×n(
×n(![]() )=
)=![]() ×0.03mol=0.045mol,所以再次反应的铜的质量为0.045mol×64g/mol=2.88g,即(m1-m2)=2.88g,故B正确,选择B。
×0.03mol=0.045mol,所以再次反应的铜的质量为0.045mol×64g/mol=2.88g,即(m1-m2)=2.88g,故B正确,选择B。


科目:高中化学 来源: 题型:
【题目】日常生活中常见电动自行车主要部件之铅蓄电池:PbO2+2H2SO4+Pb![]() PbSO4+H2O。有关说法不正确的是( )
PbSO4+H2O。有关说法不正确的是( )
A.该电池充电过程中电解质溶液pH值减小
B.该电池放电过程中将化学能转化为电能
C.放电过程中,电子由Pb电极经过导线流向PbO2
D.铅蓄电池放电过程中负极电极反应式为:Pb -2e-=Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应式_______________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3:____________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol·L-1FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变血红;
据②、③、④现象得出的结论是______________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_________________。
Ⅱ.利用如图装置作电解50 mL 0.5 mol·L-1的CuCl2溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①________________;②___________。
(2)分析实验记录B中浅蓝色固体可能是____(写化学式),试分析生成该物质的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核能的和平利用对于完成“节能减排”的目标有着非常重要的意义。尤其是核聚变,因其释放能量大,无污染,成为当前研究的一个热门课题。其反应原理为![]() +
+![]() →
→![]() +
+![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.D和T是质量数不同,质子数相同的氢的两种元素
B.通常所说的氢元素是指![]()
C.![]() 、
、![]() 、
、![]() 是氢的三种核素,互为同位素
是氢的三种核素,互为同位素
D.这个反应既是核反应,也是化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨水的叙述中,正确的是
A.氨水能导电,故NH3是电解质
B.氨水中除水外物质的量浓度最大的粒子是NH3
C.氨水显弱碱性,是因为氨水是一种弱碱
D.在1mol/L的氨水中,NH3H2O、NH3、NH![]() 的物质的量浓度之和为1mol/L
的物质的量浓度之和为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
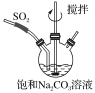
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体
请回答下列问题:
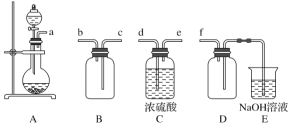
(1)实验室可利用Na2SO3和浓的硫酸制备少量SO2气体,但硫酸浓度太大不利于SO2气体逸出,原因是________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→_____→______→______→________→f。装置D的作用是___________。
(2)步骤①反应的离子方程式为________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),当生成0.5molNa2S2O4时,消耗Na2S2O5______mol。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表示,常采用Fenton氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2)∶n(Fe2+)的值对TOC去除效果的影响如图1所示:
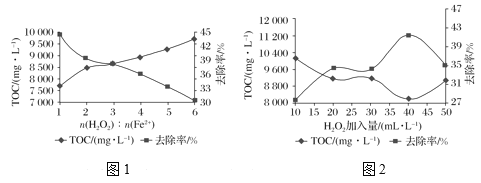
当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=________。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC去除效果的影响如图2所示,当H2O2的加入量大于40mL·L1时,TOC去除率反而减小的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析错误的是( )
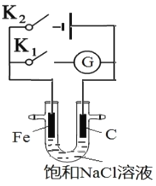
A.闭合K1构成原电池,闭合K2构成电解池
B.K1闭合,铁棒上发生的反应为:Fe﹣2e﹣═Fe2+
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K1闭合,石墨棒周围溶液pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为________
(2)NiO、FeO的晶体结构类型均与氯化钠的相同、Fe2+和Ni2+的离子半径分别78pm和69pm,则熔点FeO________ (填“<”或“>”) NiO;
(3)[Ni(NH3)6]SO4中阴离子的立体构型是_____。氨的沸点____(填“高于”或“低于”)膦(PH3),原因是_________;
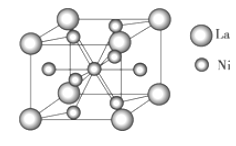
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________;
(5)某镍白铜合金的立方晶胞结构如图所示。
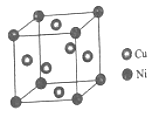
①晶胞中镍原子的堆积模型名称是_____。
②元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______
③若合金的密度为dg/cm3,晶胞参数(即边长)a =________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com