
【题目】能正确表示下列反应的离子方程式的是( )
A. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-===2Fe2++I2+3H2O
B. 0.1 mol·L-1 NH4Al(SO4)2溶液与0.2 mol·L-1 Ba(OH)2溶液等体积混合:Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
C. 向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-===A2-+H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO![]()
【答案】A
【解析】A.Fe2O3溶于过量氢碘酸溶液中的离子反应为Fe2O3+6H++2I-═2Fe2++I2+3H2O,故A正确;B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合的离子反应为2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故B错误;C.0.1 mol·L-1的NaHA溶液pH=1,说明NaHA为强酸的酸式盐,HA-能完全电离出H+,则此反应的离子方程式为H++OH-=A2-+H2O,故C错误;D.向次氯酸钠溶液中通入足量SO2气体的离子反应为ClO-+SO2+H2O═2H++Cl-+SO42-,故D错误;故选A。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是某化学小组设计的制取氯气并以氯气为反应物进行特定反应的装置,其中D装置试管内盛有水,烧杯内为沸水浴.
回答下列问题:
(1)仪器a的名称是;其中反应的化学方程式是 .
(2)C装置的作用是 .
(3)E装置中发生氧化还原反应,生成CO2和HCl(g),写出发生反应的化学方程式 . D装置的作用是 .
(4)E装置中反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A装置中仍有Cl2产生,则B装置中的现象是 .
(5)量取20mLF装置中溶液,倒入分液漏斗中,然后再注入10mLCCl4 , 盖好玻璃塞,振荡,静置、分层后分别取上层液和下层液进行试验,其中能使有色布条褪色的是(填“上层液”或“下层液”).
(6)F装置中倒置漏斗的主要作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
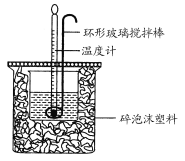
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________________________
(2)倒入NaOH溶液的正确操作是______________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______________(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________。
(5)______________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO![]() 、CO
、CO![]() 、SiO
、SiO![]() 、Cl-中的几种,现进行如下实验:
、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到白色沉淀。
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+、Mg2+、Al3+、SiO![]() 、Cl-
、Cl-
B. 该溶液中一定含有K+、AlO![]() 、CO
、CO![]() 、Cl-
、Cl-
C. 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )
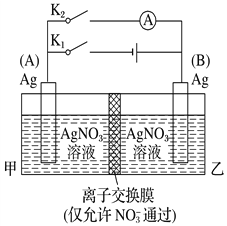
A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一整套电化学装置如右图,关于该装置说法正确的是( )
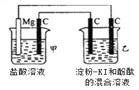
A. 甲池中Mg极为正极,电极反应式为:Mg-2e-═Mg2+
B. 甲池中C电极发生氧化反应
C. 乙池中将化学能转化为电能
D. 乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后,测量并记录溶液的温度,实验结果如下图所示,实验中始终保持V1+V2=50。

(1)对于反应:HCl+NaOH= NaCl+H2O,反应物所具有的总能量E1和生成物所具有的总能量E2的关系为:E1____E2。(填“>”、“ <”或“=”)
(2)实验中所用NaOH溶液的浓度为____mol·L-1。
(3)若含有8.0 g NaOH的稀溶液与稍过量的1 L 0.21 mol·L-1的盐酸反应放出11.46 kJ的热量,则表示中和热的热化学方程式为___________________。
(4)若取50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
①从实验装置看,其中尚缺少的一种玻璃用品是_________;
实验序号 | 起始温度t1/℃ | 终止温度 (t2)℃ | ||
盐酸 | NaOH溶液 | 平均值 | ||
1 | 25.1 | 24.9 | 25.0 | 28.0 |
2 | 25.1 | 25.1 | 25.1 | 28.2 |
3 | 25.1 | 25.1 | 25.1 | 28.3 |
4 | 25.1 | 25.1 | 25.1 | 27.4 |
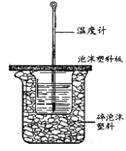
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18kJ/(kg·K),根据上表数据,求出该反应的中和热△H=____________ (保留2位小数) ;
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com