
【题目】4溴苯乙酮酸乙酯(G)是合成药物的重要中间体。工业上合成路线如下:
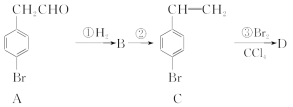
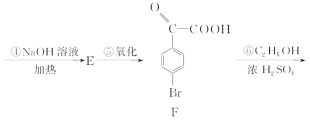
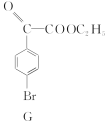
已知:加热时,![]() 在NaOH溶液中很难水解。
在NaOH溶液中很难水解。
(1)B→C的反应类型是________;E的结构简式是________________________。
(2)F中含有的官能团除羰基外的名称是________;B的名称是________。
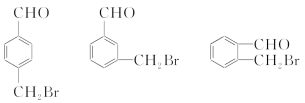
(3)满足以下条件,A的同分异构体的结构简式是____________、____________、____________。
①苯环上有两个取代基 ②能发生银镜反应 ③水解产物能被氧化成二元羧酸
(4)F经催化加氢的产物H是芳香族化合物,在一定条件下能形成六元环酯,试写出由H生成高聚物的化学方程式__________________________________。
(5)下列关于G的说法正确的是________。
a.分子式是C10H10O3Br
b.核磁共振氢谱有4种峰
c.1 mol G催化加氢,需4 mol H2
d.1 mol G完全燃烧消耗10.5 mol O2(产物之一是HBr)
【答案】(1)消去反应 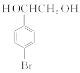
(2)溴原子、羧基 4溴苯乙醇(或对溴苯乙醇)
(3) 
(4)
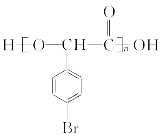 (n-1)H2O
(n-1)H2O
(5)bcd
【解析】由题中的合成路线,推断出B为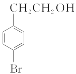 、D为
、D为 、E为
、E为 。
。
(1)  通过消去反应生成
通过消去反应生成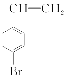 ;E的结构简式为
;E的结构简式为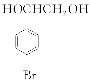 。(2)因F的结构简式为
。(2)因F的结构简式为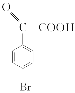 ,所含官能团的名称为羰基、溴原子、羧基;B为
,所含官能团的名称为羰基、溴原子、羧基;B为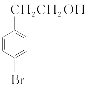 ,其名称为4溴苯乙醇(或对溴苯乙醇)。(3)因A的结构简式为
,其名称为4溴苯乙醇(或对溴苯乙醇)。(3)因A的结构简式为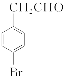 ,满足题中条件的同分异构体为
,满足题中条件的同分异构体为![]() 、
、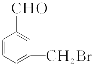 、
、![]() 。
。
(4)  催化加氢得到H的结构简式为
催化加氢得到H的结构简式为 ,因其分子结构中含羟基和羧基,在一定条件下能发生缩聚反应生成聚酯,其化学方程式为:
,因其分子结构中含羟基和羧基,在一定条件下能发生缩聚反应生成聚酯,其化学方程式为:
 +(n-1)H2O。(5)根据G的结构简式
+(n-1)H2O。(5)根据G的结构简式 可知,分子式为C10H9O3Br,a项错误;分子中含有四种不同类型的氢原子,b项正确;1 mol该物质最多能与4 mol H2加成,c项正确;依据分子式,1 mol该物质完全燃烧消耗10.5 mol O2,d项正确。
可知,分子式为C10H9O3Br,a项错误;分子中含有四种不同类型的氢原子,b项正确;1 mol该物质最多能与4 mol H2加成,c项正确;依据分子式,1 mol该物质完全燃烧消耗10.5 mol O2,d项正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于某有机物![]() 的性质叙述正确的是( )
的性质叙述正确的是( )
A.1 mol该有机物可以与3 mol Na发生反应
B.1 mol该有机物可以与3 mol NaOH发生反应
C.1 mol该有机物可以与6 mol H2发生加成反应
D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
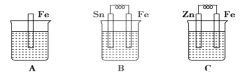
(1)以下叙述中,正确的是__________
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均有气泡产生
C.A、B两烧杯中溶液的pH均增大
D.产生气泡的速率A中比B中慢
E.B溶液中SO42-向Sn电极移动
(2)装置B变化过程中能量转化的形式主要是:____________。
(3)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是__________.
(4)A、B、C三个烧杯中铁的腐蚀速率________>_______>______
(5)对于反应2A2+B2=2A2B,已知A2、B2、A2B的键能如下表:
化学键 | A-A | B=B | A-B |
键能KJ/mol | 236 | 406 | 163 |
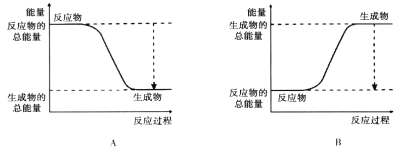
右图能正确表示该反应过程中能量变化的选项是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的各级电离能数据如下:则元素A的常见价态是( )
I1 | I2 | I3 | I4 | I5 | I6 | |
I/kJ·mol-1 | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
A. +1 B. +2 C. +3 D .+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A.AlO2﹣
B.Cu2+
C.Al3+
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是( )
A.NaCl
B.KNO3
C.FeCl2
D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )。
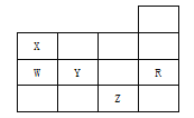
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. Y的氢化物的沸点比H2O的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列状态中,可以证明可逆反应N2 + 3H2![]() 2NH3已达平衡状态是
2NH3已达平衡状态是
①一个N≡N键断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,体系压强不再改变
④ω(NH3)、ω(N2)和ω(H2)都不再改变
⑤恒温恒容时,密度保持不变
⑥υ正(H2)=0.03 mol·L-1·min-1,υ逆(NH3)=0.02 mol·L-1·min-1
A. 全部 B. ②③④⑥ C. ③④⑤⑥ D. ②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com