
 ��1�������£���20.0g 14%��NaCl��Һ��30.0g 24%��NaCl��Һ��ϣ��õ��ܶ�Ϊ1.17g/cm3�Ļ����Һ���û����Һ��NaCl�����ʵ���Ũ��Ϊ
��1�������£���20.0g 14%��NaCl��Һ��30.0g 24%��NaCl��Һ��ϣ��õ��ܶ�Ϊ1.17g/cm3�Ļ����Һ���û����Һ��NaCl�����ʵ���Ũ��Ϊ| 1000�Ѧ� |
| M |
| 20g��14%+30g��24% |
| 20g+30g |
| 1000��1.17�� 20% |
| 58.5 |
| 1 |
| 8 |
| 1 |
| 2 |
| 33.6L |
| 22.4L/mol |
| 0.75mol��95g/mol |
| 0.5% |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| �� |
| A��O2MnO2KMnO4 |
| B��KMnO4MnO2O2 |
| C��MnO2KMnO4O2 |
| D��O2KMnO4MnO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
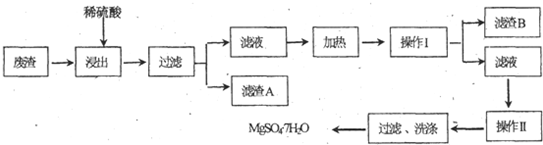

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3COOH | HCN | H2CO3 |
| Ka | 1.8��10-5 | 4.9��10-10 | K1��4.3��10-7 K2��5.6��10-11 |
| A��������ʵ���Ũ����ҺpH��ϵ��pH ��NaCN����pH ��Na2CO3����pH ��CH3COONa�� |
| B��������ʵ���Ũ�ȵ�HCN��NaCN�����Һ�У�c ��HCN��+c��H+��=c ��OH-��+c ��CN-�� |
| C��a mol/LHCN��b mol/LNaOH��Һ�������Ϻ����õ���Һ�У���c��Na+����c ��CN-������aһ��С��b |
| D����Na2CO3���뵽HCN��Һ��ʱ�������·�Ӧ��Na2CO3+HCN=NaCN+NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����º���ʱ����ClFת��40%ʱ�������ڵ�ѹǿΪ��ʼʱ��0.6 �� |
| B����c��F2����c��ClF����c��ClF3��=1��1��1����Ӧһ���ﵽƽ��״̬ |
| C���ﵽƽ��������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������ƽ������ |
| D��ƽ����ٽ����¶ȣ����ֺ��ݣ��ﵽ�µ�ƽ�⣬���������ƽ��Ħ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��FeCl3��Һ�У�Al3+��K+��MnO4-��SO42- |
| B�����ȳʻ�ɫ����Һ�У�K+��Br-��S2-��ClO- |
| C���������۲�����������Һ�У�Na+��NH4+��NO3-��Cl- |
| D��Kw/c��OH-��=0.1mol/L����Һ�У�Na+��K+��AlO2-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��
| ||
B��
| ||
C��
| ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ֽ����Ag��Cu����Һ����Ag+��Fe2+��Mg2+ |
| B����ֽ����Ag����Һ����Ag+��Cu2+��Fe2+��Mg2+ |
| C����ֽ����Ag��Cu����Һ����Fe2+��Mg2+ |
| D����ֽ����Ag��Cu��Fe����Һ����Fe2+��Mg2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com