
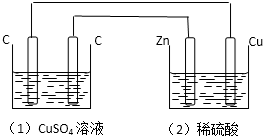
 如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线上通过了0.02mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线上通过了0.02mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )| A、(1)、(2)两装置均为电解池 |
| B、(1)、(2)溶液的PH均减小 |
| C、(1)中阳极电极反应式为:4OH--4e-═2H2O+O2↑ |
| D、(1)中阴极上析出0.32 g Cu |
| 0.02mol |
| 2 |
| 0.02mol |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.1 mol?L-1Fe3+的溶液中:K+、Mg2+、SCN-、SO42- |
| B、0.1 mol?L-1NaAlO2溶液:S2-、Na+、HCO3-、SO42- |
| C、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| D、水电离产生的c(H+)=10-12mol?L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CO32-)>c(H2CO3) |
| B、c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、c(Na+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
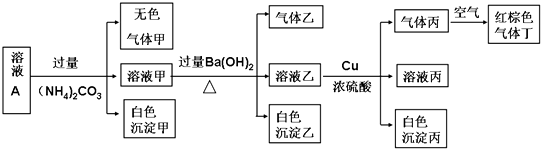
| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取5.2mL盐酸 |
| B、用pH试纸测得某溶液的pH值为12.5 |
| C、用托盘天平称取25.12gNaCl固体 |
| D、用100mL容量瓶配制50mL0.1mol/L的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com