
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到限度的标志是( )
2AB(g)达到限度的标志是( )
A. 单位时间内生成n mol A2同时生成n mol AB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )
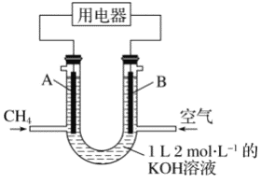
A. OH-由A端移向B端
B. V=33.6L时,溶液中的溶质为KHCO3
C. 0<V≤22.4L时,电池总反应的化学方程式为CH4+2O2+KOH===KHCO3+2H2O
D. 22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO![]() +3H2O===10HCO
+3H2O===10HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种第二代抗组胺药物的中间体G的合成路线如下:
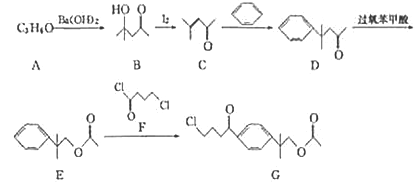
已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为__________,由A生成B的反应类型为_______。
(2)G中含氧官能团名称为_______。
(3)F的分子式为_______。
(4)由C生成D的化学方程式为______________。
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有________种结构,其中核磁共振氢谱为五组峰,且峰面积之比为1:2 : 2 : 2:9的结构简式为_____________。
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25mL0.1mol·L-1MOH溶液中逐滴加入0.2mol·L-1HA溶液,中和滴定曲线如图所示(体积变化忽略不计)。回答下列问题:
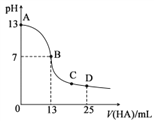
(1)写出MOH在水溶液中的电离方程式:___________。
(2)HA的电离平衡常数为___________ mol·L-l(写出计算结果)。
(3)D点时,溶液中c(A-)+c(HA)___________ 2c(M+)(填“>”“<”或“=”);溶液中离子浓度大小顺序为__________;若此时测得混合溶液的pH=a,则c(HA)+c(H+)=___________mol·L-l(用含字母a的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H= ______(用△H1、△H2、△H3表示)。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。
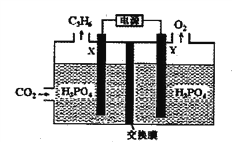
①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______(填离子符号)。
②阴极的电极反应为_____________________________。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:
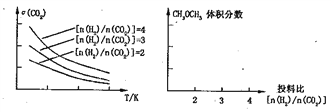
①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________。
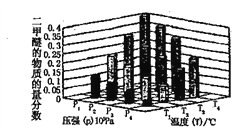
A.P4>P3>P2>P1 B .T4>T3>T2>T1 C.P1>P2>P3>P4 D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
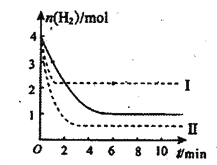
(4)不能证明该反应达到化学平衡状态的是___________。
A.气体的总压强不变
B. CH3 OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏联科学家欧巴林教授在其著作中曾说:“生命起源于甲烷”,英国科学家巴纳尔教授则认为生命是从二氧化碳和水开始的。与之相关的转化关系如图所示(部分反应条件已略去):

(1)A的结构式为________;C中官能团的电子式为________;反应②的反应类型为________。
(2)写出下列物质的结构简式:D________;H________。
(3)C→D的化学方程式为__________;二氧化碳和水经光合作用生成葡萄糖的化学方程式为_________。
(4)在自然界中纤维素与水可在甲烷菌的催化作用下生成甲烷和二氧化碳,写出该反应的化学方程式并配平:
_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。平衡常数如下表:下列说法正确的是( )
CH3OH(g)。平衡常数如下表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A. 该反应的△H> 0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用5 ×103 kPa和 250℃的条件,其原因是原料气的转化率高
D. t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com