
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 淀粉和纤维素都是高分子化合物,且都是非电解质 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
分析 A.同素异形体是同种元素组成的不同的单质;
B.淀粉和纤维素都是高分子化合物,在水溶液中和熔融状态下不导电的化合物是非电解质;
C.聚酯纤维属于有机材料;
D.石油化工的催化重整可以获得芳香烃,煤焦油中含有芳香烃.
解答 解:A.14C可用于文物年代的鉴定,14C与12C互为同位素,同素异形体是单质,故A错误;
B.淀粉和纤维素都是高分子化合物,在水溶液中和熔融状态下不导电的化合物是非电解质,所以淀粉和纤维素都是非电解质,故B正确;
C.聚酯纤维属于有机材料,光导纤维是新型无机非金属材料,故C错误;
D.石油化工的催化重整可以获得芳香烃,煤焦油中含有芳香烃,所以现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏,故D正确.
故选BD.
点评 本题考查了同位素和同分异构体的概念、石油的裂化裂解、分馏,煤的干馏,无机非金属材料等知识点,难度不大,属于基础性题目,注意基础知识的积累.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
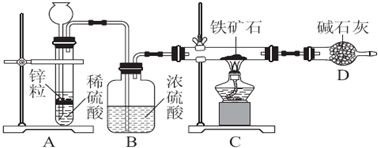
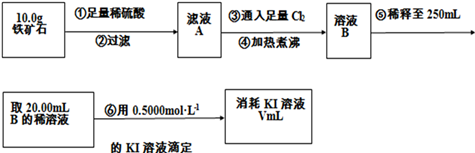
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
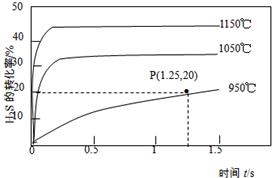 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
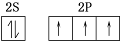 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向1mL 0.1mol/LAgNO3溶液中滴加2滴0.1mol/LNaCl溶液,振荡后,再滴加2滴0.1mol/LKI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 加热盛有浓硫酸和可抽动铜丝的试管,并将产生的气体通入到品红溶液中 | 品红溶液褪色,且试管中只产生蓝色溶液 | 浓硫酸具有强氧化性 |
| C | 向丙烯醇(HOCH2CH=CH2)中滴入少量酸性高锰酸钾溶液 | 溶液紫红色褪去 | 丙烯醇中含有碳碳双键 |
| D | 碳酸钠溶液中滴加稀硫酸后,将产生的气体通入到硅酸钠溶液中 | 产生白色沉淀 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图 | |
| C. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com