
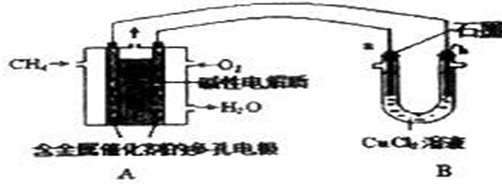
分析 ①甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根生成水和碳酸根;
②b电极为阴极,阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式计算.
解答 解:①甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根生成水和碳酸根,电极反应为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②A中消耗0.05mol氧气时,转移0.2mol电子,b电极为阴极,阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式得析出Cu的质量=$\frac{0.2mol}{2}$×64g/mol=6.4g,故答案为:b;6.4.
点评 本题综合考查学生有关电化学的有关计算等知识,难度不大,注意知识的归纳和梳理是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
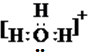 和
和 ;
;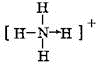 和O=C=O.
和O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤ | C. | ②③④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠溶解在AlCl3溶液中:2Na+2H2O=2Na++H2↑ | |
| B. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | MgO溶于醋酸中:MgO+2H+=H2O+Mg2+ | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
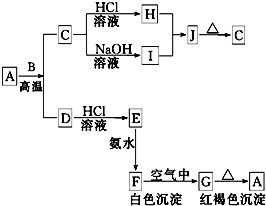 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com