
【题目】常温常压下,下列化合物以液态形式存在的是
A. 甲醛 B. 二氯甲烷 C. 丙烯 D. 丁烷
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反虑结束后的溶液中,逐滴加入5mol/L的NaOH溶液。所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。
则下列说法错误的是:
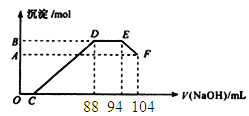
A. 铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为5:4
B. 原硝酸溶液中含硝酸的物质的量为0.5mol
C. B与A的差值为0.05 mol
D. 反应结束后的溶液仍有硝酸剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德埃特尔在哈伯研究所证实了N2与H2在固体催化剂表面合成氨的反应过程。示意图如下(![]()
![]()
![]() 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
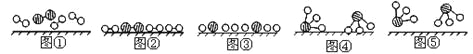
图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,则图③表示 。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。酸性KMnO4溶液与NaNO2反应的离子方程式是:MnO4-+NO2-+X![]() Mn2++NO3-+H2O(未配平),X表示的粒子是 。酸性高锰酸钾 (“能”或“不能”)鉴别食盐中是否存在NaNO2,理由是___________________
Mn2++NO3-+H2O(未配平),X表示的粒子是 。酸性高锰酸钾 (“能”或“不能”)鉴别食盐中是否存在NaNO2,理由是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题:
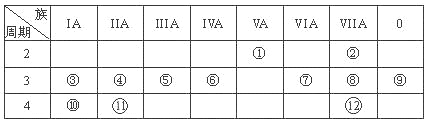
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针发生偏转
D.每转移0.1mol电子,理论上生成10.35 g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
A.加入适量的氯化按晶体后,两溶液的pH均减小
B.温度降低10℃,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.分别用盐酸中和,消耗的盐酸体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A. 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B. 若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为 a:b
C. 若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D. 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>’’、“<’’或“ =’’)》
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH) 3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前最主要的温室气体,减小CO2的排放并用来制造有价值的化学用品是目前的研究目标。
(1)利用CO2与CH4生产合成气(CO、H2):
已知:CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3 KJ·mol-1
CO2(g)+2H2O(g) ΔH=-890.3 KJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+2.8 KJ·mol-1
CO2(g)+H2(g) ΔH=+2.8 KJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.0 KJ·mol-1
2CO2(g) ΔH=-566.0 KJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) ΔH= ____________。
2CO(g)+2H2(g) ΔH= ____________。
②250℃时,以镍合金为催化剂,向体积为4 L的密闭容器中通入6 mol CO2、6 mol CH4,开始发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。经过一段时间达到平衡,平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
2CO(g)+2H2(g)。经过一段时间达到平衡,平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的可能原因是____________________。

(3) 如以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为_____________________。
(4)将2mol CO2和6molH2容积相同而温度不同的Ⅰ、Ⅱ两个恒容密闭容器中开始发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如下图1所示。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如下图1所示。


①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_______KⅡ(填“>”“=”或“<”),可知该 反应是一个_______(填“放热”或“吸热”)反应。
②下列事实说明该反应已达到平衡状态的是_________________:
A.容器内气体压强保持不变
B.容器内气体的密度保持不变
C.CO2的体积分数保持不变
D.CO2的消耗速率与CH3OH的生成速率相等
E.容器内混合气体的平均相对分子质量保持不变
(5)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如上图2所示。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com