
用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量 1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值 110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量 57.3 kJ;
(6)可逆反应:aA(气)+bB(气) cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
(16分)(1)=;(2)>;(3)<;(4)>;(5)>;(6)①< ②< ③>
解析试题分析:(1)根据盖斯定律可知,反应热只与反应物和生成物的始态与终态有关系,而与反应条件无关系,所以ΔH1=ΔH2;
(2)断键是吸热的,而形成化学键是放热的,因此相同条件下,2mol氢原子所具有的能量>1mol氢分子所具有的能量;
(3)常温时红磷比白磷稳定,这说明白磷的总能量高于红磷的总能量,所以白磷转化为红磷是放热反应。根据盖斯定律可知,①-②即得到反应4P(白磷,s)=4P(红磷,s),则该反应的反应热△H=ΔH1-ΔH2<0,所以ΔH1<ΔH2;
(4)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。由于碳完全燃烧放出的热量高于碳不完全燃烧放出的热量,所以根据热化学方程式2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1可知,碳的燃烧热数值>110.5 kJ·mol-1;
(5)中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水放出热量,所以根据方程式H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol可知,浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量>57.3 kJ;
(6)①根据图像可知,压强为P2的曲线首先达到平衡状态,由于压强大反应速率快,达到平衡的时间少,所以压强是P2大于P1,即P1<P2;
②根据图像可知,压强越大,反应物A的转化率越低,这说明增大压强平衡向逆反应方向越低,因此正方应是体积增大的可逆反应,所以(a+b)<(c+d);
③根据图像可知,t1℃是曲线首先达到平衡状态,由于温度高,反应速率快,达到平衡的时间少,所以温度应该是t1℃> t2℃。
考点:考查反应热的判断、计算;外界条件对反应速率和平衡状态的影响以及图像识别等


科目:高中化学 来源: 题型:填空题
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应: 2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是 (填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g)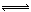 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
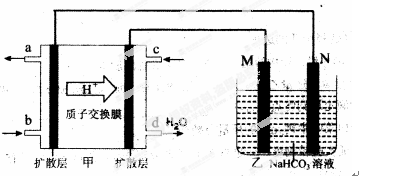
(4)某实验小组设想如下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。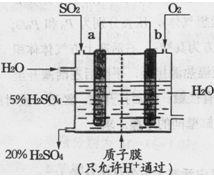
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
SO2(g)+O2(g) 2SO3(g) △H1="-197" kJ/mol;
2SO3(g) △H1="-197" kJ/mol;
H2O(g)=H2O(1) △H2="-44" kJ/mol:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(1) H3="-545" kJ/mol。
写出SO3(g)与H2O(1)反应的热化学方程式是 。
(6)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比 。[已知该温度时,Ksp(BaSO4)=1.3x10-10,KsP(BaCO3)=5.2x10-9]。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某化学兴趣小组要完成反应热的测定。实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌器、0.50mol· L-1盐酸、0.50mol· L-1NaOH溶液,实验尚缺少的玻璃用品是_____________、_______________。
(2)已知2molCO气体完全燃烧生成CO2 气体放出566 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。写出用标准燃烧热作为反应热的CO燃烧的热化学方程式__________________。
若1 molCH4气体完全燃烧生成CO2固体和液态水,放出热量_____890 kJ( 填“>”、 “<”、“=”)。若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。
(l)图中所示反应是______(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H=_______(用含 、
、 的代数式表示)。
的代数式表示)。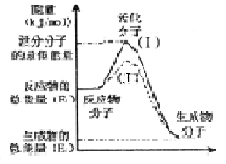
(2)已知热化学方程式:H2(g) +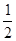 O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为___________________________。
⑵某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_____________________(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1  W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。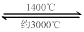 WI4 (g)。下列说法正确的有____________。
WI4 (g)。下列说法正确的有____________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是
| A.采用高温 |
| B.采用高压 |
| C.寻找更高效的催化剂 |
| D.减小体系内CO2浓度 |
 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1 H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H3 (填“大于”、“小于”或“等于”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同): 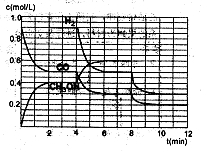
①下列说法正确的是
| A.起始时n(H2)为1.7mol |
| B.当容器内压强恒定时,说明反应达到平衡状态 |
| C.4分钟时,改变的条件是升高温度 |
| D.7分钟时,v(CO)=v(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com